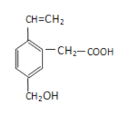
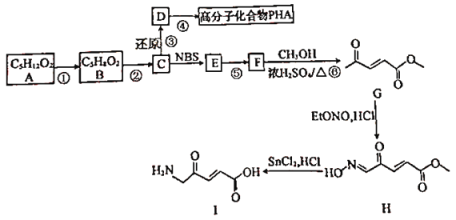
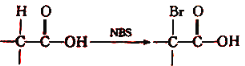
题目内容
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A原子核内只有1个质子;B原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C原子最外层的电子数比次外层的多4;C的简单阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D2C;C、E同主族。回答下列问题:
(1)B在元素周期表中的位置为______________________。
(2)E的氧化物对应的水化物有______________________ (写化学式)。
(3)B、C、D、E形成的简单离子半径由大到小的关系是______________________(用离子符号表示)。
(4)化合物D2C的形成过程为______________________(用电子式表示)。
(5)由A、B、C三种元素形成的常见的离子化合物的化学式为___________,该化合物的水溶液与强碱溶液共热发生反应的离子方程式为______________________。
(6)化合物D2EC3在一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为______________________。
【答案】第二周期第ⅤA族 H2SO3、H2SO4 S2->N3->O2->Na+ ![]() NH4NO3 NH4++OH-
NH4NO3 NH4++OH-![]() NH3↑+H2O 4Na2SO3
NH3↑+H2O 4Na2SO3![]() Na2S+ 3Na2SO4
Na2S+ 3Na2SO4
【解析】
A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,则A为H元素;B的最高价氧化物对应水化物的化学式为HBO3,则B的最高化合价为+5价,位于周期表第ⅤA族,B元素的原子半径是其所在主族中最小的,应为N元素;C元素原子的最外层电子数比次外层多4个,只能有2个电子层,最外层电子数为6,应为O元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的化合价为+1价,D为Na元素;C、E主族,则E为S元素,据此解答。
A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,则A为H元素;B的最高价氧化物对应水化物的化学式为HBO3,则B的最高化合价为+5价,位于周期表第ⅤA族,B元素的原子半径是其所在主族中最小的,应为N元素;C元素原子的最外层电子数比次外层多4个,只能有2个电子层,最外层电子数为6,应为O元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的化合价为+1价,D为Na元素;C、E主族,则E为S元素,
(1)B为N元素,在周期表中的位置是:第二周期第ⅤA族;
(2)E为S元素,氧化物对应的水化物有H2SO3、H2SO4;
(3)B、C、D、E分别为N、O、Na、S,形成的简单离子S2-多一个电子层,N3-、O2-、Na+具有相同电子层结构核电荷数越大半径越小,则半径由大到小的关系是:S2->N3->O2->Na+;
(4)Na2O为离子化合物,用电子式表示Na2O的形成过程为:![]() ;
;
(5)由A、B、C三种元素形成的常见的离子化合物硝酸铵的化学式为NH4NO3,该化合物的水溶液与强碱溶液共热发生反应的离子方程式为NH4++OH-![]() NH3↑+H2O;
NH3↑+H2O;
(6)化合物D2EC3(Na2SO3)在一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐Na2S,则此反应的化学方程式为4Na2SO3![]() Na2S+ 3Na2SO4。
Na2S+ 3Na2SO4。

【题目】室温下,向100 mL 0.1 mol/L NH4Cl溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A | 100 mL0.1 mol/L盐酸 | 溶液中2c(NH4+)= c(Cl-) |
B | 0.01 mol Na2O2固体 | 反应完全后,溶液pH增大,c(Na+)= 2c(Cl-) |
C | 100 mL H2O | 由水电离出的c(H+)·c(OH-)变大(均自由离子) |
D | 100 mL 0.1 mol/L氨水 | 溶液中 |
A. A B. B C. C D. D
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

选项 | W | X |
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A. A B. B C. C D. D