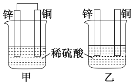
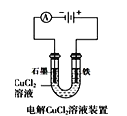
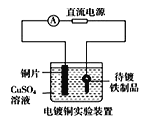
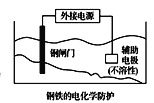
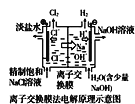
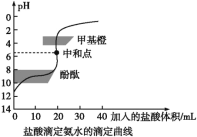
题目内容
【题目】H2和CO合成甲醇反应为:CO(g)+2H2(g)![]() CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2molCO和1molH2,10min后达到平衡,测得含有0.4molCH3OH(g)。则达到平衡时CO的浓度为___;10min内用H2表示的化学反应速率为___;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有___(填一种合理的措施)。
CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2molCO和1molH2,10min后达到平衡,测得含有0.4molCH3OH(g)。则达到平衡时CO的浓度为___;10min内用H2表示的化学反应速率为___;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有___(填一种合理的措施)。
【答案】0.4mol/L 0.04mol/(L·min) 增大压强(或增加H2的量)
【解析】
根据三段式分析解答达到平衡时CO的浓度和10min内用H2表示的化学反应速率;由于该反应是体积减小的反应,根据影响平衡移动和化学反应速率的因素分析判断加快CH3OH的生成速率并提高CO的转化率的方法。
CO(g)+2H2(g)CH3OH(g)(正反应是放热反应)
开始量(mol):1.21 0
转化量(mol):0.40.8 0.4
平衡量(mol):0.80.2 0.4
达到平衡时CO的浓度为![]() =0.4mol/L,10min内用H2的浓度变化量△c(H2)=
=0.4mol/L,10min内用H2的浓度变化量△c(H2)=![]() =0.4mol/L,10min内用H2表示的平均反应速率v=
=0.4mol/L,10min内用H2表示的平均反应速率v=![]() =0.04mol/(L·min);由于该反应是气体体积减小的放热反应,因此可以通过增大压强或充入氢气的方法提高CH3OH的生成速率,并提高CO的转化率,故答案为:0.4mol/L;0.04mol/(L·min);增大压强(或增加H2的量)。
=0.04mol/(L·min);由于该反应是气体体积减小的放热反应,因此可以通过增大压强或充入氢气的方法提高CH3OH的生成速率,并提高CO的转化率,故答案为:0.4mol/L;0.04mol/(L·min);增大压强(或增加H2的量)。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
①2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
②2CH3OH(g)![]() C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
③CH3CH2OH(g)![]() CH3OCH3(g) △H3= +50.7kJmol-1
CH3OCH3(g) △H3= +50.7kJmol-1
④C2H5OH(g)![]() C2H4(g)+ H2O(g) △H4=akJmol-1
C2H4(g)+ H2O(g) △H4=akJmol-1
回答下列问题:
(1)a=___________。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①欲提高C2H5OH的平衡转化率,应采取的措施为___________(填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________,平衡时C2H5OH的转化率为_______(结果保留两位有效数字,下同),该反应的平衡常数K=_________。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____mol,n(C2H5OH)=_____mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______,由此规律推出反应在12h时c(C2H5OH)等于______molL-1
反应时间t/h | 0 | 4 | 8 | 16 |
c(C2H5OH)/(molL-1) | 0.10 | 0.051 | 0.026 | 0.0065 |
【题目】下列“实际应用”对应“化学知识原理”说法错误的是( )
选项 | 实际应用 | 化学知识原理 |
A | 泡沫灭火器中装有碳酸氢钠溶液 和硫酸铝溶液 | 碳酸氢钠溶液和硫酸铝溶液水解且相互促进 |
B | 工业上采用高压(20-50MPa)合成NH3 | 应用勒夏特列原理 |
C | 施加石膏降低盐碱地(含Na2CO3)的碱性 | CaCO3溶度积小于CaSO4 |
D | 选用金属锂做电池电极材料 | 锂轻且在空气中稳定 |
A. AB. BC. CD. D