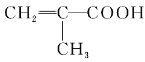
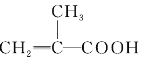题目内容
【题目】乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
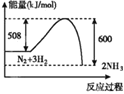
①2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
②2CH3OH(g)![]() C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
③CH3CH2OH(g)![]() CH3OCH3(g) △H3= +50.7kJmol-1
CH3OCH3(g) △H3= +50.7kJmol-1
④C2H5OH(g)![]() C2H4(g)+ H2O(g) △H4=akJmol-1
C2H4(g)+ H2O(g) △H4=akJmol-1
回答下列问题:
(1)a=___________。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①欲提高C2H5OH的平衡转化率,应采取的措施为___________(填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________,平衡时C2H5OH的转化率为_______(结果保留两位有效数字,下同),该反应的平衡常数K=_________。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____mol,n(C2H5OH)=_____mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______,由此规律推出反应在12h时c(C2H5OH)等于______molL-1
反应时间t/h | 0 | 4 | 8 | 16 |
c(C2H5OH)/(molL-1) | 0.10 | 0.051 | 0.026 | 0.0065 |
【答案】+45.5 ad ![]() ×100% 94% 1.5
×100% 94% 1.5 ![]() 0.1×(2-
0.1×(2-![]() ) 达到平衡前每间隔4h,c(C2H5OH)减少约一半 0.013
) 达到平衡前每间隔4h,c(C2H5OH)减少约一半 0.013
【解析】
(1)利用盖斯定律构造目标热化学方程式求焓变;
(2)反应是吸热反应,反应前后气体体积增大,结合平衡移动原理分析判断转化率;
(3)相同条件下压强之比等于物质的量之比,反应前后物质的量的增大是反应的C2H5OH的物质的量,结合转化率概念计算得到;依据化学平衡三段式列式计算平衡常数;
(4)依据平衡C2H5OH的浓度计算,依据图表数据分析判断存在的规律。
(1)①2CH3OH(g)═CH3OCH3(g)+H2O(g)△H1=-23.9kJmol-1,②2CH3OH(g)═C2H4(g)+2H2O(g) △H2=-29.1kJmol-1,③C2H5OH(g)═CH3OCH3(g) △H3=+50.7kJmol-1,根据盖斯定律①-②-③可得:C2H4(g)+H2O(g)═C2H5OH(g) △H=(-23.9+29.1-50.7)kJ/mol =-45.5kJ/mol,则C2H5OH(g)![]() C2H4(g)+ H2O(g) △H4=+45.5kJmol-1,故答案为:+45.5;
C2H4(g)+ H2O(g) △H4=+45.5kJmol-1,故答案为:+45.5;
(2)①在一定温度进行如下反应:C2H5OH(g)![]() C2H4(g)+ H2O(g)△H4=+45.5kJmol-1,反应是吸热反应,反应后气体体积增大,根据平衡移动原理分析可知,欲提高乙醇的平衡转化率,平衡需要正向移动,可以升温或减压,故答案为:ad;
C2H4(g)+ H2O(g)△H4=+45.5kJmol-1,反应是吸热反应,反应后气体体积增大,根据平衡移动原理分析可知,欲提高乙醇的平衡转化率,平衡需要正向移动,可以升温或减压,故答案为:ad;
②反应后气体物质的量增大量等于反应的乙醇的量,所以由总压强P和起始压强P0计算反应物乙醇的转化率α(C2H5OH)的表达式=![]() ×100%;平衡时C2H5OH的转化率=
×100%;平衡时C2H5OH的转化率=![]() ×100%=94.1%;
×100%=94.1%;
C2H5OH(g) ![]() C2H4(g) + H2O(g)
C2H4(g) + H2O(g)
起始量(mol/L) 0.10 0 0
变化量(mol/L) 0.10×94.1% 0.10×94.1% 0.10×94.1%
平衡量(mol/L)0.10(1-94.1%) 0.10×94.1% 0.10×94.1%
K=![]() =
=![]() =1.5mol/L,故答案为:
=1.5mol/L,故答案为:![]() ×100%;94.1%;1.5mol/L;
×100%;94.1%;1.5mol/L;
(3)①由总压强P和起始压强P0表示反应体系的总物质的量n总和反应物C2H5OH的物质的量n(C2H5OH),依据压强之比等于物质的量之比,n总∶n起始=P∶P0 ,n总=![]() ;
;
C2H5OH(g)![]() C2H4(g)+ H2O(g)
C2H4(g)+ H2O(g)
起始量(mol) 0.10 0 0
变化量(mol) x x x
某时刻量(mol)0.10-x x x
(0.10+x)∶0.10=P∶P0,解得:x=![]() ,因此n(C2H5OH)=0.10-
,因此n(C2H5OH)=0.10-![]() =0.10×(2-
=0.10×(2-![]() )mol,故答案为:
)mol,故答案为:![]() ;0.10×(2-
;0.10×(2-![]() );
);
(3)分析数据特征可知,每隔4h,C2H5OH的浓度减小一半,由此规律推出反应在12h时反应物的浓度c(C2H5OH)=![]() =0.013mol/L,故答案为:达到平衡前每间隔4h,c(C2H5OH)减少约一半;0.013。
=0.013mol/L,故答案为:达到平衡前每间隔4h,c(C2H5OH)减少约一半;0.013。

【题目】(1)元素周期表是我们研究物质性质、结构的重要工具,对周期表的熟悉和掌握程度直接影响我们对化学的学习。元素周期表共有七个周期十六个族;第ⅠA族元素(除氢外)的最高价氧化物对应水化物都是易溶于水的强碱,又称为___元素,卤族元素位于第__纵行,最高正价与最低负价的绝对值相等的元素位于___族。
(2)A、B、C、D、E、F、G为原子序数依次增大的前20号元素(此时不考虑稀有气体元素),在周期表中B和C,C和E分别相邻,B、E、G的最外层电子数之和为12。已知部分元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
A | 该元素有一种核素质量数为1 |
B | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
D | 原子的次外层电子数是最外层电子数的两倍 |
①由元素A、B形成的核外电子总数为10e-的两种微粒:___,___(写化学式)。
②C元素在周期中的位置:___。
③C、D形成的化合物在通讯上的重要用途___。
④E与G两元素可形成化合物,用电子式表示其化合物的形成过程:___。
⑤用化学方程式表示B、D两种元素的非金属性强弱___。
⑥A、B、F三种元素形成的一种常见化合物易溶于水,受热易分解,可用于制作干电池,该物质的电子式是___。