题目内容
15.一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为67.2g,当其缓慢经过无水CaCl2时,CaCl2增重32.4g,则原混合气体中CO2的质量为( )| A. | 8.4 g | B. | 26.4 g | C. | 30.2 g | D. | 34.8 g |
分析 CH4燃烧产物为CO、CO2、H2O(g),产物通过无水CaCl2时,无水CaCl2的作用是吸收水分,无水CaCl2增重32.4g为水的质量,根据H原子守恒可计算CH4的物质的量,根据C原子守恒可计算CO和CO2的总的物质的量,再根据二者质量可计算CO2的物质的量,进而计算CO2质量.
解答 解:无水CaCl2增重32.4g为水的质量,所以n(H2O)=$\frac{32.4g}{18g/mol}$=1.8mol,
根据H原子守恒,可知:n(CH4)=$\frac{1}{2}$n(H2O)=$\frac{1}{2}$×1.8mol=0.9mol,
根据C原子守恒,则:n(CO)+n(CO2)=0.9mol,
一氧化碳和二氧化碳的总质量为:m(CO)+m(CO2)=67.2g-32.4g=34.8g,
所以[0.9mol-n(CO2)]×28g/mol+n(CO2)×44g/mol=34.8g,
解得:n(CO2)=0.6mol,
所以生成二氧化碳的质量为:0.6mol×44g/mol=26.4g,
故选B.
点评 本题考查混合物的计算,题目难度中等,注意从质量守恒定律的角度解答,关键根据水的质量判断甲烷的物质的量,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
5.下列说法中,不正确的是( )
| A. | 氯气可用于消毒和制造漂白粉 | B. | 氨气可用于制造氮肥 | ||
| C. | 乙烯可用于制造塑料 | D. | 铝制容器可用于盛放稀硫酸 |
6.已知:1mol H2(g)与1mol Br2(g)完全反应生成2mol HBr(g)时放出72kJ的热量,有关物质的相关数据如下表:
则表中a为( )
| 化学键 | H2(g) | Br2(g) | HBr(g) |
| 断裂1mol化学键需要吸收的能量/kJ | 436 | a | 369 |
| A. | 404 | B. | 260 | C. | 230 | D. | 200 |
10.下列物质中,只含有非极性共价键的是( )
| A. | H2 | B. | NaCl | C. | H2S | D. | NaOH |
7.下列反应中生成物总能量高于反应物总能量的氧化还原反应是( )
| A. | CO2与C反应 | B. | Al与稀盐酸反应 | ||
| C. | CaCO3受热分解 | D. | Ba(OH)2?8H2O与NH4Cl固体反应 |
4.下列有关除杂质(括号中为杂质)的操作中,错误的是( )
| A. | 乙醇(水):加入足量生石灰充分振荡,蒸馏,收集馏出物 | |
| B. | CCl4(乙醇):多次加水,振荡,分液,弃水层 | |
| C. | 苯(己烯):加溴水,振荡,过滤除去沉淀 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
5.下列关于工业生产的叙述中,错误的是( )
| A. | 制普通玻璃的主要原料是纯碱、石灰石、石英 | |
| B. | 氨是制作氮肥、硝酸、铵盐的重要原料 | |
| C. | 将氢气和氯气混合光照生成氯化氢,溶于水制得盐酸 | |
| D. | 制造普通水泥的主要原料是黏土、石灰石 |
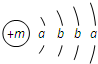 某种融雪剂,其主要成分的化学式为XY2,图为X原子的结构示意图,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
某种融雪剂,其主要成分的化学式为XY2,图为X原子的结构示意图,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.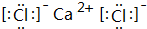 .
.