题目内容
7.下列反应中生成物总能量高于反应物总能量的氧化还原反应是( )| A. | CO2与C反应 | B. | Al与稀盐酸反应 | ||
| C. | CaCO3受热分解 | D. | Ba(OH)2?8H2O与NH4Cl固体反应 |
分析 生成物总能量高于反应物总能量的反应属于吸热反应,根据常见的放热反应和吸热反应进行判断;有化合价变化的反应为氧化还原反应,根据化合价是否变化判断;
常见的放热反应有:所有的物质燃烧、所有金属与酸、所有中和反应、绝大多数化合反应,铝热反应;
常见的吸热反应有:个别的化合反应(如C和CO2)、绝大数分解反应、少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:A.CO2与C反应,属于吸热反应,生成物总能量高于反应物总能量,并且碳化合价发生变化,属于氧化还原反应,故A正确;
B.铝与稀盐酸反应属于放热反应,生成物的总能量小于反应物的总能量,故B错误;
C.碳酸钙受热分解分解制氧气属于吸热反应,生成物总能量高于反应物总能量,但无化合价变化,不属于氧化还原反应,故C错误;
D.Ba(OH)2?8H2O与NH4Cl固体反应,属于吸热反应,生成物总能量高于反应物总能量,但无化合价变化,不属于氧化还原反应,故D错误.
故选A.
点评 本题主要考查了放热反应和放热反应以及氧化还原反应的判断,题目难度不大,掌握常见的放热反应和放热反应是解题的关键.

练习册系列答案
相关题目
18.已知酸性强弱顺序为H2CO3>C6H5OH>HCO3-,下列化学方程式正确的是( )
| A. | C6H5ONa+H2O+CO2→C6H5OH+NaHCO3 | |
| B. | C6H5ONa+H2O+CO2→C6H5OH+Na2CO3 | |
| C. | 2C6H5OH+Na2CO3→2C6H5ONa+CO2↑+H2O | |
| D. | C6H5OH+NaHCO3→C6H5ONa+H2CO3 |
15.一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为67.2g,当其缓慢经过无水CaCl2时,CaCl2增重32.4g,则原混合气体中CO2的质量为( )
| A. | 8.4 g | B. | 26.4 g | C. | 30.2 g | D. | 34.8 g |
2.对某一可逆反应来说,使用催化剂的作用是( )
| A. | 改变平衡混合物的组成 | B. | 提高反应物的平衡转化率 | ||
| C. | 以同样程度改变正逆反应速率 | D. | 增大正反应速率,降低逆反应速率 |
16.下列各装置能构成原电池的是( )
| A. | 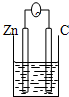 稀硫酸 | B. | 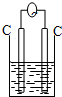 AgNO3(aq) | C. | 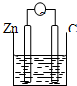 蔗糖 | D. | 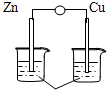 稀硫酸 |
17.下列叙述正确的是( )
| A. | 离子键只有饱和性没有方向性 | B. | 离子晶体中只含有离子键 | ||
| C. | 离子键的强弱可用晶格能来衡量 | D. | 离子键的强弱可用原子化热来衡量 |
 ,所含化学键类型为共价键.
,所含化学键类型为共价键.