题目内容
3.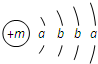 某种融雪剂,其主要成分的化学式为XY2,图为X原子的结构示意图,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
某种融雪剂,其主要成分的化学式为XY2,图为X原子的结构示意图,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.(1)m=20,该融雪剂的电子式为
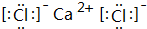 .
.(2)元素Z、W的名称为硫、碳.
(3)下列说法中正确的是BCD
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含共价键
C.H2Z没有HY稳定
D.X的阳离子半径比Y的阴离子半径小.
分析 X原子的结构示意图为 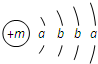 ,由于K最多容纳2个电子,L层最多容纳8个电子,可知a=2,b=8,故X为Ca元素;由化学XY2可知Y的化合价为-1价,而X的阳离子与Y的阴离子的电子层结构相同,离子核外电子数均为18,则Y原子核外电子数为17,故Y为Cl,则该融雪剂为CaCl2;元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,符合条件的元素有He、C、S,由于Z与Y相邻且Z、W能形成一种WZ2型分子,则Z为S元素,W为C元素,二者形成的分子为CS2,据此解答.
,由于K最多容纳2个电子,L层最多容纳8个电子,可知a=2,b=8,故X为Ca元素;由化学XY2可知Y的化合价为-1价,而X的阳离子与Y的阴离子的电子层结构相同,离子核外电子数均为18,则Y原子核外电子数为17,故Y为Cl,则该融雪剂为CaCl2;元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,符合条件的元素有He、C、S,由于Z与Y相邻且Z、W能形成一种WZ2型分子,则Z为S元素,W为C元素,二者形成的分子为CS2,据此解答.
解答 解:X原子的结构示意图为 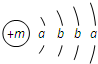 ,由于K最多容纳2个电子,L层最多容纳8个电子,可知a=2,b=8,故X为Ca元素;由化学XY2可知Y的化合价为-1价,而X的阳离子与Y的阴离子的电子层结构相同,离子核外电子数均为18,则Y原子核外电子数为17,故Y为Cl,则该融雪剂为CaCl2;元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,符合条件的元素有He、C、S,由于Z与Y相邻且Z、W能形成一种WZ2型分子,则Z为S元素,W为C元素,二者形成的分子为CS2.
,由于K最多容纳2个电子,L层最多容纳8个电子,可知a=2,b=8,故X为Ca元素;由化学XY2可知Y的化合价为-1价,而X的阳离子与Y的阴离子的电子层结构相同,离子核外电子数均为18,则Y原子核外电子数为17,故Y为Cl,则该融雪剂为CaCl2;元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,符合条件的元素有He、C、S,由于Z与Y相邻且Z、W能形成一种WZ2型分子,则Z为S元素,W为C元素,二者形成的分子为CS2.
(1)由上述分析可知,m=2+8+8+2=20,该融雪剂的化学式为CaCl2,电子式为: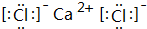 ,
,
故答案为:20;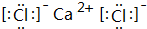 ;
;
(2)由上述分析可知,Z为硫元素、W为碳元素,
故答案为:硫;碳;
(3)A.CaCl2属于离子化合物,而CS2是共价化合物,故A错误;
B.CaCl2中仅含离子键,CS2中只含共价键,且是极性共价键,故B正确;
C.因氯的非金属性强于硫,所以稳定性HCl>H2S,故C正确;
D.核外电子排布相同的离子,核电荷数越大,离子的半径越小,所以半径Ca2+<Cl-,故D正确,
故选:BCD.
点评 本题考查的知识点较多,涉及核外电子排布、电子式、化学键、元素周期律、微粒半径比较等,难度不大,根据核外电子排布和原子结构推导出元素是解题的关键,注意对基础知识的掌握.

| A. | 2.8 mol | B. | 1.6 mol | C. | 0.4 mol | D. | 3.2 mol |
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)硒的熔点范围可能是113℃~450℃
(2)碲的化合价可能有-2,+4,+6
(3)氢硒酸有较强的还原性(填“氧化性”或“还原性”),因此把它放在空气中长期保存容易变质,其可能发生的化学方程式为2H2Se+O2=2H2O+2Se↓.
| A. | 此电池工作时会发出蓝色火焰 | |
| B. | 燃料电池具有能量转化率高、可持续使用的优点 | |
| C. | 该电池的负极电极反应式为:2H2+4e-═4H+ | |
| D. | 该电池的正极电极反应式为:O2+2H2O+4e-═4OH- |
| A. | C6H5ONa+H2O+CO2→C6H5OH+NaHCO3 | |
| B. | C6H5ONa+H2O+CO2→C6H5OH+Na2CO3 | |
| C. | 2C6H5OH+Na2CO3→2C6H5ONa+CO2↑+H2O | |
| D. | C6H5OH+NaHCO3→C6H5ONa+H2CO3 |
| A. | 加入BaCl2溶液有白色沉淀生成,加稀盐酸沉淀不消失,原溶液一定有SO42- | |
| B. | 加入AgNO3溶液有白色沉淀生成,加稀盐酸沉淀不消失,原溶液一定有Cl- | |
| C. | 加入盐酸产生能使澄清石灰水变浑浊的气体,原溶液中可能有CO32-或SO32- | |
| D. | 加入NaOH并加热,产生使湿润蓝色石蕊试纸变红的气体,原溶液是铵盐溶液 |
| A. | 8.4 g | B. | 26.4 g | C. | 30.2 g | D. | 34.8 g |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
| B | 常温下,将铁片浸入足量浓硫酸中 | 铁片不溶解 | 常温下,铁与浓硫酸一定没有发生化学反应 |
| C | 向某食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该实验中一定没有添加KIO3 |
| D | 向苯酚钠溶液滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比苯酚强 |
| A. | A | B. | B | C. | C | D. | D |