题目内容
某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如下图所示的装置。请回答下列问题。
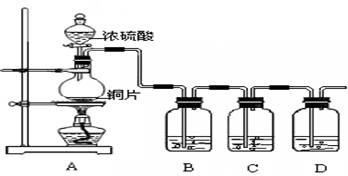
(1)铜和浓硫酸反应中浓硫酸的作用为 (A、强氧化剂 B、强还原剂)。
(2)B瓶中盛有品红溶液,观察到品红溶液褪色,这是因为 SO2具有 ,C瓶中盛有新制的氯水,观察到氯水褪色,这是因为SO2具有 。(填选项的字母)
A.氧化性 B.还原性 C.漂白性
(3)D瓶中盛有足量NaOH溶液以除去SO2,该反应的主要产物的化学式为 。
(4)充分反应后,小组同学发现铜和硫酸都有剩余。若想使剩余的铜片溶解,可再加入
(填选项的字母)。
A.HNO3 B.NaNO3 C.NaHCO3 D.Na2CO3

(1)铜和浓硫酸反应中浓硫酸的作用为 (A、强氧化剂 B、强还原剂)。
(2)B瓶中盛有品红溶液,观察到品红溶液褪色,这是因为 SO2具有 ,C瓶中盛有新制的氯水,观察到氯水褪色,这是因为SO2具有 。(填选项的字母)
A.氧化性 B.还原性 C.漂白性
(3)D瓶中盛有足量NaOH溶液以除去SO2,该反应的主要产物的化学式为 。
(4)充分反应后,小组同学发现铜和硫酸都有剩余。若想使剩余的铜片溶解,可再加入
(填选项的字母)。
A.HNO3 B.NaNO3 C.NaHCO3 D.Na2CO3
(1)强氧化剂(A) (2)C B
(3)Na2SO3 (4)AB
(3)Na2SO3 (4)AB
略

练习册系列答案
相关题目