题目内容
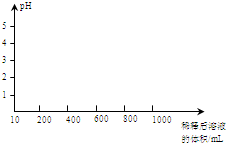 常温下,有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答有关问题:
常温下,有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答有关问题:(1)取10mL的甲溶液,加入等体积的水,醋酸的电离平衡
| c(H+) |
| c(CH3COOH) |
(2)相同条件下,分别取10mL的甲、乙两溶液,各稀释到原溶液体积的100倍在图中分别画出甲、乙两溶液的pH随溶液体积变化的曲线示意图.
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)
(4)取25mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中离子浓度的大小关系为:
(5)取等体积的甲、乙两溶液相混合,CH3COOH的电离平衡常数将
考点:弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)醋酸是弱电解质,加水稀释促进醋酸电离;向醋酸中加入醋酸钠固体,溶液中醋酸根离子浓度增大,抑制醋酸电离;
(2)氯化氢是强电解质,完全电离,醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进醋酸电离,所以稀释相同的倍数,醋酸溶液氢离子浓度大于盐酸溶液,则PH乙大于甲;
(3)pH相等的醋酸和盐酸,醋酸的浓度大于盐酸,等体积等pH的两种酸,醋酸的物质的量大于盐酸,酸的物质的量越多需要等浓度的氢氧化钠溶液体积越大;
(4)pH=12的NaOH溶液中c(NaOH)=0.02mol/L,pH=2的醋酸中c(CH3COOH)>0.02mol/L,二者等体积混合,醋酸过量,溶液呈酸性,根据电荷守恒分析;
(5)电离平衡常数是温度的函数;因为电离平衡常数不变,两者混合体积扩大一倍,氢离子浓度不变,所以电离平衡不移动.
(2)氯化氢是强电解质,完全电离,醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进醋酸电离,所以稀释相同的倍数,醋酸溶液氢离子浓度大于盐酸溶液,则PH乙大于甲;
(3)pH相等的醋酸和盐酸,醋酸的浓度大于盐酸,等体积等pH的两种酸,醋酸的物质的量大于盐酸,酸的物质的量越多需要等浓度的氢氧化钠溶液体积越大;
(4)pH=12的NaOH溶液中c(NaOH)=0.02mol/L,pH=2的醋酸中c(CH3COOH)>0.02mol/L,二者等体积混合,醋酸过量,溶液呈酸性,根据电荷守恒分析;
(5)电离平衡常数是温度的函数;因为电离平衡常数不变,两者混合体积扩大一倍,氢离子浓度不变,所以电离平衡不移动.
解答:
解:(1)醋酸是弱电解质,加水稀释促进醋酸电离,所以醋酸电离平衡向正反应方向移动;向醋酸中加入醋酸钠固体,溶液中醋酸根离子浓度增大,抑制醋酸电离,则氢离子浓度减小,醋酸分子浓度增大,所以c(H+)/c(CH3COOH)减小,故答案为:向右;减小;
(2)氯化氢是强电解质,完全电离,醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进醋酸电离,所以稀释相同的倍数,醋酸溶液氢离子浓度大于盐酸溶液,则PH乙大于甲,所以图象为:
 ,故答案为:
,故答案为: ;
;
(3)pH相等的醋酸和盐酸,醋酸的浓度大于盐酸,等体积等pH的两种酸,醋酸的物质的量大于盐酸,酸的物质的量越多需要等浓度的氢氧化钠溶液体积越大,所以V(甲)大于V(乙),故答案为:大于;
(4)pH=12的NaOH溶液中c(NaOH)=0.02mol/L,pH=2的醋酸中c(CH3COOH)>0.02mol/L,二者等体积混合,醋酸过量,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(Na+)<c(CH3COO-),所以离子浓度大小顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(5)电离平衡常数是温度的函数;因为电离平衡常数不变,两者混合体积扩大一倍,氢离子浓度不变,所以电离平衡不移动,所以氯离子和醋酸根离子浓度不变,
故答案为:不变;等于.
(2)氯化氢是强电解质,完全电离,醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进醋酸电离,所以稀释相同的倍数,醋酸溶液氢离子浓度大于盐酸溶液,则PH乙大于甲,所以图象为:
 ,故答案为:
,故答案为: ;
;(3)pH相等的醋酸和盐酸,醋酸的浓度大于盐酸,等体积等pH的两种酸,醋酸的物质的量大于盐酸,酸的物质的量越多需要等浓度的氢氧化钠溶液体积越大,所以V(甲)大于V(乙),故答案为:大于;
(4)pH=12的NaOH溶液中c(NaOH)=0.02mol/L,pH=2的醋酸中c(CH3COOH)>0.02mol/L,二者等体积混合,醋酸过量,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(Na+)<c(CH3COO-),所以离子浓度大小顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(5)电离平衡常数是温度的函数;因为电离平衡常数不变,两者混合体积扩大一倍,氢离子浓度不变,所以电离平衡不移动,所以氯离子和醋酸根离子浓度不变,
故答案为:不变;等于.
点评:本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,注意相同浓度的不同酸稀释时其pH变化大小,结合电荷守恒分析解答,难度中等.

练习册系列答案
相关题目
在25℃,0.1mol?L-1的CH3COONa溶液已达平衡,为了使CH3COO-的水解程度减小,溶液的pH值增大,可加入的物质是( )
| A、CH3COONa |
| B、H2O |
| C、盐酸 |
| D、CH3COOH |
铝和镓的性质相似,如M(OH)3都是难溶的两性氢氧化物.在自然界镓常以极少量分散于铝矿中.用NaOH溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2;而后通入适量CO2,得Al(OH)3沉淀,而NaGaO2留在溶液中(循环多次后成为提取镓的原料).发生后一步反应是因为( )
| A、镓酸酸性强于铝酸 |
| B、铝酸酸性强于镓酸 |
| C、镓浓度小,不沉淀 |
| D、Al(OH)3是难溶物 |
下列依据相关实验得出的结论正确的是( )
| A、向漂白粉上加入较浓的盐酸,产生的气体不能使湿润淀粉碘化钾试纸变蓝,说明该漂白粉已经失效 |
| B、向某溶液中加入稀硝酸再滴入Ba(NO3)2溶液产生白色沉淀,该溶液一定含SO42- |
| C、向FeCl2溶液中滴加少量KSCN溶液变血红色,说明FeCl2完全被氧化成FeCl3 |
| D、向浓度均为0.1mol?L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)<Ksp(AgI) |
0.2mol有机物和0.6mol O2在密闭容器燃烧后的产物为CO2和H2O,经过浓硫酸后,浓硫酸质量增加10.8g,再通过碱石灰被完全吸收,碱石灰质量增加17.6g,该有机物恰好与4.6g金属钠完全反应,则该有机物的结构简式为( )
| A、CH3CH2OH |
| B、CH3CHO |
| C、CH3CH2CH2OH |
| D、CH3COOH |
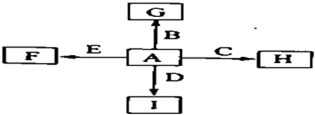 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应: D.
D.