题目内容
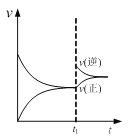
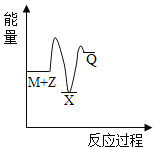
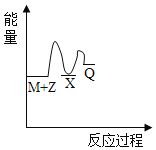
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。若生成0.5molN2,下列说法不正确的是( )

A.反应生成1molN2时转移4mole-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139kJ·mol-1
D.断键吸收能量之和小于成键释放能量之和
【答案】A
【解析】
由图可知反应物的总能大于生成物的总能量,反应为放热反应,可根据图中数据确定反应热。
A.由图可知发生的归中反应为N2O+NO=N2+NO2,N2O中N元素化合价从+1价降低到0价,NO 中N元素化合价从+2价升高到+4价,生成1molN2时转移2mole-,A项错误;
B. 由图可知反应物的总能大于生成物的总能量,B项正确;
C. ΔH=![]() =209 kJ·mol-1-348 kJ·mol-1=-139 kJ·mol-1,C项正确;
=209 kJ·mol-1-348 kJ·mol-1=-139 kJ·mol-1,C项正确;
D. ΔH=反应物的总键能-生成物的总键能=139 kJ·mol-1<0,则有反应物的总键能小于生成物的总键能,即断键吸收能量之和小于成键释放能量之和,D项正确;
答案选A。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目