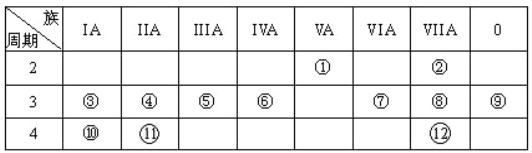
题目内容
【题目】电石法(乙炔法)制氯乙烯是最早完成工业化的生产氯乙烯的方法。
反应原理为HC≡CH+HCl![]() CH2=CHCl(HgCl2/活性炭作催化剂)。某学习小组的同学用下列装置测定该反应中乙炔的转化率(不考虑其他副反应)。铁架台及夹持仪器未画出。(已知
CH2=CHCl(HgCl2/活性炭作催化剂)。某学习小组的同学用下列装置测定该反应中乙炔的转化率(不考虑其他副反应)。铁架台及夹持仪器未画出。(已知![]() 的熔点为-159.8℃,沸点为-134℃。乙炔、氯乙烯、氯化氢均不溶于液体A)
的熔点为-159.8℃,沸点为-134℃。乙炔、氯乙烯、氯化氢均不溶于液体A)

(1)各装置的连接顺序为(箭头方向即为气流方向):_________→________→_________→h→_________→______→_________→__________
(2)戊装置除了均匀混合气体之外,还有_________和_________的作用。
(3)乙装置中发生反应的化学方程式为_________________________________。
(4)若实验所用的电石中含有1.28gCaC2,甲装置中产生0.02mol的HCl气体。则所选用的量筒的容积较合理的是_______![]() 填字母代号
填字母代号![]() 。
。
A.500ml B.1000ml C.2000ml
(5)假定在标准状况下测得庚中收集到的液体A的体积为672ml(导管内气体体积忽略不计),则乙炔的转化率为_________。
【答案】![]() f e g c d j 干燥气体 观察气体流速
f e g c d j 干燥气体 观察气体流速 ![]()
![]() 50%
50%
【解析】
(1)根据反应过程可知,装置乙的作用为制取乙炔,利用装置丁除去杂质后,在戊装置中干燥、控制气体流速以及使气体混合均匀,在装置丙中发生反应后生成氯乙烯,利用装置己和庚测定气体的体积,据此连接装置;
(2)装置乙中制得的乙炔,利用装置丁除去杂质后,与装置甲制得的HCl在戊装置中干燥、控制气体流速以及使气体混合均匀后在装置丙中发生反应后生成氯乙烯,由此确定装置戊的作用;
(3)乙装置中发生的反应为电石与水生成乙炔和氢氧化钙;
(4)碳化钙的物质的量为![]() ,可计算出0.02molHCl反应产生的氯乙烯在标准状况下的体积,再考虑乙炔不能全部转化及乙炔、氯乙烯、氯化氢均不溶于液体A, 据此选择量筒的体积;
,可计算出0.02molHCl反应产生的氯乙烯在标准状况下的体积,再考虑乙炔不能全部转化及乙炔、氯乙烯、氯化氢均不溶于液体A, 据此选择量筒的体积;
(5)碳化钙的物质的量为![]() ,可计算出乙炔与0.02molHCl气体的总体积,乙炔、氯乙烯、氯化氢均不溶于液体A,由此可计算出乙炔的转化率。
,可计算出乙炔与0.02molHCl气体的总体积,乙炔、氯乙烯、氯化氢均不溶于液体A,由此可计算出乙炔的转化率。
(1)根据给定装置图分析可知甲装置用于制取氯化氢,乙装置用于制取乙炔,丙装置用于氯乙烯的制备,丁装置用于除去乙炔中的杂质,戊装置用于干燥、控制气体流速以及使气体混合均匀,己和庚用于测定气体的体积,所以装置的连接顺序为:b;f;e;g; c;d;j;
(2)戊装置用于干燥、控制气体流速以及使气体混合均匀等;
(3)碳化钙与水反应的化学方程式为:![]() ;
;
(4)碳化钙的物质的量为![]() ,与0.02molHCl反应产生的氯乙烯在标准状况下的体积为0.02mol×22.4L/mol=0.448L=448ml,考虑乙炔不能全部转化及乙炔、氯乙烯、氯化氢均不溶于液体A, 所以应选取1000mL的量筒;
,与0.02molHCl反应产生的氯乙烯在标准状况下的体积为0.02mol×22.4L/mol=0.448L=448ml,考虑乙炔不能全部转化及乙炔、氯乙烯、氯化氢均不溶于液体A, 所以应选取1000mL的量筒;
(5)碳化钙的物质的量为![]() ,故乙炔与0.02molHCl气体的总体积在标准状况下为(0.02mol+0.02mol) ×22.4L/mol=0.896L=896mL,乙炔、氯乙烯、氯化氢均不溶于液体A,所以乙炔的转化率为
,故乙炔与0.02molHCl气体的总体积在标准状况下为(0.02mol+0.02mol) ×22.4L/mol=0.896L=896mL,乙炔、氯乙烯、氯化氢均不溶于液体A,所以乙炔的转化率为![]() 。
。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】现有7瓶失去标签的试剂瓶,已知它们盛装的液体可能是乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖溶液、蔗糖溶液。现通过如下实验来确定各试剂中所装液体的名称。
实验步骤和方法 | 实验现象 |
①把7瓶液体依次标号为A、B、C、D、E、F、G后闻气味 | 只有F、G两种液体没有气味 |
②各取少量于试管中加水稀释 | 只有C、D、E三种液体不溶解而浮在水上层 |
③分别取少量7种液体于试管中加新制的 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
④各取C、D、E少量于试管中,加稀 | 只有C中仍有分层现象,且在D的试管中闻到特殊香味 |
(1)试写出下列序号代表的液体名称:
A________,B________,C_______,D_______,E______,F______,G________。
(2)写出在D中加入![]() 溶液并加热的化学方程式:_______。
溶液并加热的化学方程式:_______。
【题目】以硅藻土为载体的五氧化二钒![]() 是接触法生成硫酸的催化剂。从废钒催化剂中回收
是接触法生成硫酸的催化剂。从废钒催化剂中回收![]() 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 |
|
|
|
|
|
|
质量分数 |
|
|
|
|
|
|
如图1是一种废钒催化剂回收工艺路线:
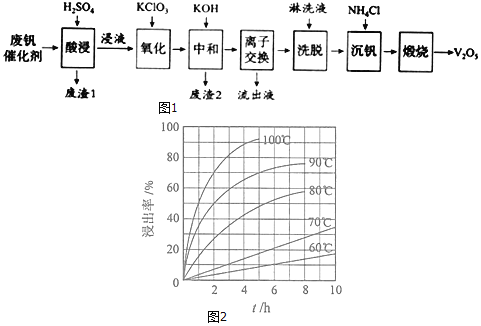
回答下列问题:
(1)“酸浸”时![]() 转化为
转化为![]() ,反应的离子方程式为______,同时
,反应的离子方程式为______,同时![]() 转成
转成![]() 为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有______
为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有______![]() 写出两条
写出两条![]() 。“废渣1”的主要成分是______。
。“废渣1”的主要成分是______。
(2)“酸浸”实验中,钒的浸出率结果如图2所示。由图可知,当钒的浸出率为![]() 时,所采用的实验条件为______。
时,所采用的实验条件为______。
(3)“氧化”中欲使3mol的![]() 变为
变为![]() ,则需要氧化剂
,则需要氧化剂![]() 至少为______mol。
至少为______mol。
(4)“中和”作用之一是使钒以![]() 形式存在于溶液中。“废渣2”中含有______。
形式存在于溶液中。“废渣2”中含有______。
(5)“离子交换”和“洗脱”可简单表示为:![]()
![]()
![]() 为强碱性阴离子交换树脂
为强碱性阴离子交换树脂![]() 。为了提高洗脱效率,淋洗液应该呈______性
。为了提高洗脱效率,淋洗液应该呈______性![]() 填“酸”、“碱”或“中”
填“酸”、“碱”或“中”![]() 。
。
(6)“流出液”中阳离子最多的是______。
(7)“沉钒”得到偏钒酸铵![]() 沉淀,写出“煅烧”中发生反应的化学方程式______。
沉淀,写出“煅烧”中发生反应的化学方程式______。