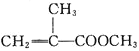题目内容
【题目】为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
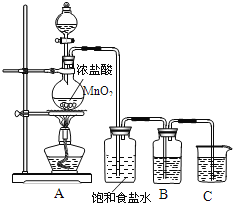
(1)盛装MnO2的仪器名称:_____
(2)实验室制氯气的反应原理为:__HCl(浓)+__MnO2 =加热=__MnCl2+__Cl2↑+__H2O(请将方程式中反应系数补充完整)
(3)盛有饱和食盐水的洗气瓶的作用是______.
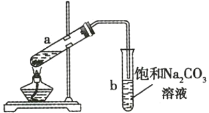
(4)装置B中盛放的试剂是______(填选项),实验现象为______.
a.Na2S溶液b.Na2SO3溶液c.Na2SO4溶液
(5)装置C中盛放烧碱稀溶液,目的是______.
(6)能证明氯元素比硫元素非金属性强的依据为______.(填序号)
①氯原子比硫原子更容易获得电子形成离子;
②次氯酸的氧化性比稀硫酸强;
③S2-比Cl-还原性强;
④HCl比H2S稳定.
【答案】圆底烧瓶 4 1 1 1 2 除掉HCl杂质 a 溶液变浑浊 处理尾气,防止污染环境 ①③④
【解析】
浓盐酸与二氧化锰反应生成氯气,浓盐酸易挥发,氯气中含有HCl杂质,先用饱和食盐水除掉HCl杂质,再利用氧化还原反应验证氯的非金属性比硫强,再用氢氧化钠溶液处理多余的氯气。
⑴盛装MnO2的仪器名称:圆底烧瓶;故答案为:圆底烧瓶。
⑵根据氧化还原反应,氯升高变为氯气,得到1mol氯气失去2mol电子,锰降低,1mol MnO2得到2mol电子,根据得失电子守恒配平,实验室制氯气的反应原理为:4HCl(浓)+1MnO2 ![]() 1MnCl2+1Cl2↑+2H2O;故答案为:4;1;1;1;2。
1MnCl2+1Cl2↑+2H2O;故答案为:4;1;1;1;2。
⑶浓盐酸易挥发,氯气中含有HCl杂质,因此盛有饱和食盐水的洗气瓶的作用是除掉HCl杂质;故答案为:除掉HCl杂质。
⑷为验证氯非金属性强于硫,因此通过氧化还原反应来进行验证,利用Cl2+S2=S↓+2Cl-,装置B中盛放的试剂是a,实验现象为溶液变浑浊;故答案为:a;溶液变浑浊。
⑸验证氯非金属性强于硫后,由于氯气过量会污染环境,因此装置C中盛放烧碱稀溶液,目的是处理尾气,防止污染环境;故答案为:处理尾气,防止污染环境。
⑹①根据得电子难易程度来比较,由于氯原子比硫原子更容易获得电子形成离子,则氯元素比硫元素非金属性强,故①符合题意;②次氯酸的氧化性比稀硫酸强,不能得出氯元素比硫元素非金属性强,故②不符合题意;③还原性越强,非金属性越弱,S2比Cl-还原性强,则氯元素比硫元素非金属性强,故③符合题意;④氢化物越稳定,则非金属性越强,HCl比H2S稳定,则氯元素比硫元素非金属性强,故④符合题意;故答案为:①③④。

【题目】甲基丙烯酸甲酯的结构简式为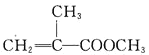 ,是有机玻璃的单体,其一种实验室制备方法如下:实验装置如图1所示(夹持装置及微波加热装置已略去):
,是有机玻璃的单体,其一种实验室制备方法如下:实验装置如图1所示(夹持装置及微波加热装置已略去):
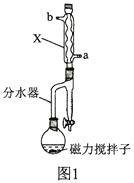
实验步骤如下:
Ⅰ![]() 量取86ml甲基丙烯酸
量取86ml甲基丙烯酸![]()
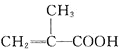
![]() 置于烧杯中,在搅拌的同时加入5ml浓硫酸,冷却至室温,再加入50ml甲醇,搅拌,混合均匀;
置于烧杯中,在搅拌的同时加入5ml浓硫酸,冷却至室温,再加入50ml甲醇,搅拌,混合均匀;
Ⅱ![]() 将混合溶液注入图1装置的反应器中,加入磁力搅拌子,微波加热温度为105℃,持续加热,充分反应;
将混合溶液注入图1装置的反应器中,加入磁力搅拌子,微波加热温度为105℃,持续加热,充分反应;
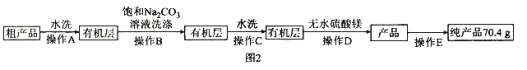
Ⅲ![]() 纯化产品,流程如图2所示:
纯化产品,流程如图2所示:
已知:
|
|
| |
溶解性 | 可溶于有机物、水 | 可溶于热水、酯 | 难溶于水、可溶于有机物 |
密度/gcm-3 | 0.79 | 1.01 | 0.94 |
沸点/℃ | 64.7 | 161 | 100~101 |
相对分子质量 | 32 | 86 | 100 |
回答下列问题:
(1)制备甲基丙烯酸甲酯的化学方程式为______________________________。
(2)图1中仪器X的名称为________________,其进水口应为________________(填“a”或“b”)口。
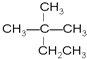
(3)采用微波加热可准确控制反应温度和时间,若反应温度控制不好,可能有副产物产生,写出一种有机副产物的结构简式:_________。
(4)从分水器中及时分离出水的目的是_____________________,如果分水器中的水层不再增厚,则表明__________________________。
(5)纯化过程中,用“饱和碳酸钠溶液洗涤”的目的是_______________________________;完成操作C应选____________(填选项字母,下同)装置,完成操作D应选____________装置。
(6)本实验中甲基丙烯酸甲酯的产率为_________________![]() 保留三位有效数字
保留三位有效数字![]() 。
。
【题目】(1)将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
①在反应体系中加入催化剂,该反应的反应热_____(填“增大”、“减小”或“不变”)。
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率υ(N2)=___________,H2的转化率为_____________(保留小数点后一位)。
③欲提高②容器中H2的转化率,下列措施可行的是____________。
a.把气体的体积压缩至1L b.向容器中再充入惰性气体
c.改变反应的催化剂 d.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
4NH3(g)+3O2(g) ΔH=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a_________0。(填“大于”、“小于”或“等于”)
【题目】以硅藻土为载体的五氧化二钒![]() 是接触法生成硫酸的催化剂。从废钒催化剂中回收
是接触法生成硫酸的催化剂。从废钒催化剂中回收![]() 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 |
|
|
|
|
|
|
质量分数 |
|
|
|
|
|
|
如图1是一种废钒催化剂回收工艺路线:
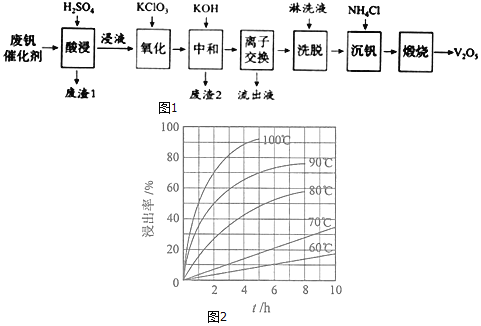
回答下列问题:
(1)“酸浸”时![]() 转化为
转化为![]() ,反应的离子方程式为______,同时
,反应的离子方程式为______,同时![]() 转成
转成![]() 为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有______
为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有______![]() 写出两条
写出两条![]() 。“废渣1”的主要成分是______。
。“废渣1”的主要成分是______。
(2)“酸浸”实验中,钒的浸出率结果如图2所示。由图可知,当钒的浸出率为![]() 时,所采用的实验条件为______。
时,所采用的实验条件为______。
(3)“氧化”中欲使3mol的![]() 变为
变为![]() ,则需要氧化剂
,则需要氧化剂![]() 至少为______mol。
至少为______mol。
(4)“中和”作用之一是使钒以![]() 形式存在于溶液中。“废渣2”中含有______。
形式存在于溶液中。“废渣2”中含有______。
(5)“离子交换”和“洗脱”可简单表示为:![]()
![]()
![]() 为强碱性阴离子交换树脂
为强碱性阴离子交换树脂![]() 。为了提高洗脱效率,淋洗液应该呈______性
。为了提高洗脱效率,淋洗液应该呈______性![]() 填“酸”、“碱”或“中”
填“酸”、“碱”或“中”![]() 。
。
(6)“流出液”中阳离子最多的是______。
(7)“沉钒”得到偏钒酸铵![]() 沉淀,写出“煅烧”中发生反应的化学方程式______。
沉淀,写出“煅烧”中发生反应的化学方程式______。