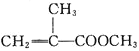题目内容
【题目】我国化学家侯德榜改革国外的制碱工艺,发明了著名的联合制碱法,其生产流程如下图所示。请根据工艺流程,回答下列问题。

![]() 沉淀池中发生反应的化学方程式是________。该工艺流程中,首先向沉淀池中加入足量饱和食盐水,然后先通入________
沉淀池中发生反应的化学方程式是________。该工艺流程中,首先向沉淀池中加入足量饱和食盐水,然后先通入________![]() 填化学式
填化学式![]() ,再通入________
,再通入________![]() 填化学式
填化学式![]() ,使得固体B结晶析出。
,使得固体B结晶析出。
![]() 请设计实验检验固体产品C中是否含有氯化钠。
请设计实验检验固体产品C中是否含有氯化钠。![]() 默认产品中的阳离子均为钠离子
默认产品中的阳离子均为钠离子![]() _________。
_________。
![]() 向母液中通入氨气并加入细小的食盐颗粒,可冷却析出副产品D,其化学式为________,剩余母液可循环利用。
向母液中通入氨气并加入细小的食盐颗粒,可冷却析出副产品D,其化学式为________,剩余母液可循环利用。
![]() 煅烧炉中发生反应的化学方程式是________。所得产品C中往往还含有少量未反应的固体B。若称取mg产品并加热至恒重,剩余固体质量为
煅烧炉中发生反应的化学方程式是________。所得产品C中往往还含有少量未反应的固体B。若称取mg产品并加热至恒重,剩余固体质量为![]() ,则产品中物质C的质量分数为________。
,则产品中物质C的质量分数为________。
![]() 将提纯后纯净的物质B与
将提纯后纯净的物质B与![]() 以
以![]() 物质的量之比
物质的量之比![]() 混合,置于一密闭容器内共热
混合,置于一密闭容器内共热![]() 加热前容器内只含有固体混合物和氮气
加热前容器内只含有固体混合物和氮气![]() 。充分反应后将剩余固体物质干燥并测定其组成。干燥后固体物质的主要成分是_____
。充分反应后将剩余固体物质干燥并测定其组成。干燥后固体物质的主要成分是_____![]() 填化学式
填化学式![]() ,次要成分是________
,次要成分是________![]() 填化学式
填化学式![]() ,主要成分与次要成分的物质的量之比为________。
,主要成分与次要成分的物质的量之比为________。
【答案】![]()
![]()
![]()
![]() 取少量固体置于试管,加适量水溶解,滴加适量硝酸酸化的硝酸银溶液,若有白色沉淀生成,证明产品中有
取少量固体置于试管,加适量水溶解,滴加适量硝酸酸化的硝酸银溶液,若有白色沉淀生成,证明产品中有![]() ;若无白色沉淀生成,证明产品中无
;若无白色沉淀生成,证明产品中无![]()
![]()
![]()
![]()
![]()
![]()
![]() NaOH
NaOH ![]()
【解析】
联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,反应过程是向氨化的饱和氯化钠溶液中通入二氧化碳气体,则A为CO2气体,反应生成碳酸氢钠晶体和氯化铵溶液,过滤得到碳酸氢钠固体(固体B)和含有NH4Cl溶液的母液;固体B加热分解得到纯碱(产品C)和CO2气体(A);母液中通入NH3可析出NH4Cl(副产品D),剩余溶液可循环利用。
![]() 沉淀池中是侯氏制碱法的主要反应原理:
沉淀池中是侯氏制碱法的主要反应原理:![]() ,该工艺主要应用相同条件下
,该工艺主要应用相同条件下![]() 在水中溶解度小于NaCl和
在水中溶解度小于NaCl和![]() ,所以在饱和NaCl溶液中形成
,所以在饱和NaCl溶液中形成![]() 过饱和溶液,使
过饱和溶液,使![]() 结晶析出。在实际操作中,是首先向饱和NaCl溶液中通入
结晶析出。在实际操作中,是首先向饱和NaCl溶液中通入![]() 气体,因为氨气极易溶于水,先形成浓度较大的碱性溶液,再通入过量的
气体,因为氨气极易溶于水,先形成浓度较大的碱性溶液,再通入过量的![]() 气体,使之更多的转化为
气体,使之更多的转化为![]() ,然后以
,然后以![]() 结晶析出;
结晶析出;
![]() 检查
检查![]() 中是否含有NaCl,实际就是检查是否存在
中是否含有NaCl,实际就是检查是否存在![]() ,则操作步骤为:取少量固体置于试管,加适量水溶解,先滴加适量硝酸酸化,再滴加硝酸银溶液,若有白色沉淀生成,证明产品中有
,则操作步骤为:取少量固体置于试管,加适量水溶解,先滴加适量硝酸酸化,再滴加硝酸银溶液,若有白色沉淀生成,证明产品中有![]() ;若无白色沉淀生成,证明产品中无
;若无白色沉淀生成,证明产品中无![]() ;
;
![]() 母液为含有少量
母液为含有少量![]() 的
的![]() 溶液,再次通入氨气,加入食盐颗粒,使溶液中
溶液,再次通入氨气,加入食盐颗粒,使溶液中![]() 和
和![]() 浓度增大,所以会有
浓度增大,所以会有![]() 固体析出;
固体析出;
![]() 在煅烧炉中受热分解的化学方程式为2NaHCO3
在煅烧炉中受热分解的化学方程式为2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
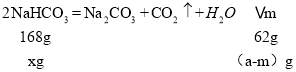
![]() 则:
则:![]() 质量为mg-
质量为mg-![]() g=
g=![]() g,产品中
g,产品中![]() 质量分数为
质量分数为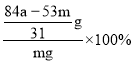 =
=![]() ;
;
![]() 为
为![]() ,受热分解的化学方程式为2NaHCO3
,受热分解的化学方程式为2NaHCO3![]() Na2CO3+CO2↑+H2O,设密闭容器内NaHCO3为3mol,Na2O2为2mol;则3molNaHCO3完全分解生成的Na2CO3、CO2和H2O均为1.5mol;由2Na2O2+2CO2=2Na2CO3+O2可知,1.5mol CO2完全反应需要1.5mol Na2O2,同时生成1.5molNa2CO3,则与水反应的Na2O2为2mol-1.5mol=0.5mol,由2Na2O2+2H2O=4NaOH+O2可知反应生成的NaOH为1mol,故反应结束后固体为3molNa2CO3和1molNaOH,即主要成分为
Na2CO3+CO2↑+H2O,设密闭容器内NaHCO3为3mol,Na2O2为2mol;则3molNaHCO3完全分解生成的Na2CO3、CO2和H2O均为1.5mol;由2Na2O2+2CO2=2Na2CO3+O2可知,1.5mol CO2完全反应需要1.5mol Na2O2,同时生成1.5molNa2CO3,则与水反应的Na2O2为2mol-1.5mol=0.5mol,由2Na2O2+2H2O=4NaOH+O2可知反应生成的NaOH为1mol,故反应结束后固体为3molNa2CO3和1molNaOH,即主要成分为![]() ,次要成分为NaOH,两者的物质的量之比为3:1。
,次要成分为NaOH,两者的物质的量之比为3:1。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】现有7瓶失去标签的试剂瓶,已知它们盛装的液体可能是乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖溶液、蔗糖溶液。现通过如下实验来确定各试剂中所装液体的名称。
实验步骤和方法 | 实验现象 |
①把7瓶液体依次标号为A、B、C、D、E、F、G后闻气味 | 只有F、G两种液体没有气味 |
②各取少量于试管中加水稀释 | 只有C、D、E三种液体不溶解而浮在水上层 |
③分别取少量7种液体于试管中加新制的 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
④各取C、D、E少量于试管中,加稀 | 只有C中仍有分层现象,且在D的试管中闻到特殊香味 |
(1)试写出下列序号代表的液体名称:
A________,B________,C_______,D_______,E______,F______,G________。
(2)写出在D中加入![]() 溶液并加热的化学方程式:_______。
溶液并加热的化学方程式:_______。
【题目】已知下列操作和现象,所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2 (g) | 增大压强,平衡逆向移动 |
B | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热;未出现银镜 | 蔗糖未水解 |
C | 向蛋白质溶液中加入CuSO4溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
D | 其他条件相同时,Na2S2O3溶液和稀H2SO4反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
A. AB. BC. CD. D
【题目】甲基丙烯酸甲酯的结构简式为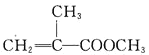 ,是有机玻璃的单体,其一种实验室制备方法如下:实验装置如图1所示(夹持装置及微波加热装置已略去):
,是有机玻璃的单体,其一种实验室制备方法如下:实验装置如图1所示(夹持装置及微波加热装置已略去):
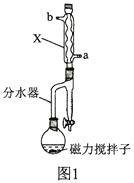
实验步骤如下:
Ⅰ![]() 量取86ml甲基丙烯酸
量取86ml甲基丙烯酸![]()
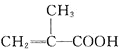
![]() 置于烧杯中,在搅拌的同时加入5ml浓硫酸,冷却至室温,再加入50ml甲醇,搅拌,混合均匀;
置于烧杯中,在搅拌的同时加入5ml浓硫酸,冷却至室温,再加入50ml甲醇,搅拌,混合均匀;
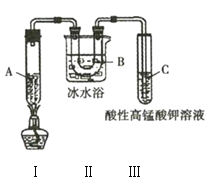
Ⅱ![]() 将混合溶液注入图1装置的反应器中,加入磁力搅拌子,微波加热温度为105℃,持续加热,充分反应;
将混合溶液注入图1装置的反应器中,加入磁力搅拌子,微波加热温度为105℃,持续加热,充分反应;
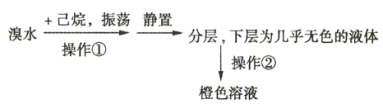
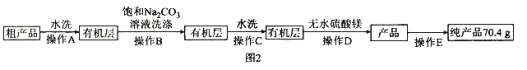
Ⅲ![]() 纯化产品,流程如图2所示:
纯化产品,流程如图2所示:
已知:
|
|
| |
溶解性 | 可溶于有机物、水 | 可溶于热水、酯 | 难溶于水、可溶于有机物 |
密度/gcm-3 | 0.79 | 1.01 | 0.94 |
沸点/℃ | 64.7 | 161 | 100~101 |
相对分子质量 | 32 | 86 | 100 |
回答下列问题:
(1)制备甲基丙烯酸甲酯的化学方程式为______________________________。
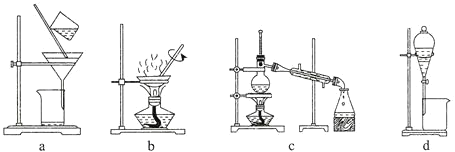
(2)图1中仪器X的名称为________________,其进水口应为________________(填“a”或“b”)口。
(3)采用微波加热可准确控制反应温度和时间,若反应温度控制不好,可能有副产物产生,写出一种有机副产物的结构简式:_________。
(4)从分水器中及时分离出水的目的是_____________________,如果分水器中的水层不再增厚,则表明__________________________。
(5)纯化过程中,用“饱和碳酸钠溶液洗涤”的目的是_______________________________;完成操作C应选____________(填选项字母,下同)装置,完成操作D应选____________装置。
(6)本实验中甲基丙烯酸甲酯的产率为_________________![]() 保留三位有效数字
保留三位有效数字![]() 。
。