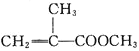题目内容
【题目】⑴可正确表示原子轨道的是___。
A.2s B.2d C.3p D.3f
⑵写出基态镓(Ga)原子的电子排布式:___。
⑶下列物质变化,只与范德华力有关的是___。
A.干冰熔化 B.乙酸汽化 C.乙醇与丙酮混溶 D.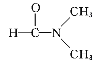 溶于水
溶于水
E.碘溶于四氯化碳 F.石英熔融
⑷下列物质中,只含有极性键的分子是___,既含离子键又含共价键的化合物是___;只存在σ键的分子是___,同时存在σ键和π键的分子是___。
A.N2 B.CO2 C.CH2Cl2 D.C2H4 E.C2H6 F.CaCl2 G.NH4Cl
⑸用“>”“<”或“=”填空:
第一电离能的大小:Mg___Al;熔点的高低:KCl___MgO。
【答案】AC 1s22s22p63s23p63d104s24p1 AE BC G CE ABD > <
【解析】
⑴根据第几能层就有几个能级,因此可正确表示原子轨道的是2s、3p;故答案为:AC。
⑵Ga核外有31个电子,故基态镓(Ga)原子的电子排布式:1s22s22p63s23p63d104s24p1;故答案为:1s22s22p63s23p63d104s24p1。
⑶A. 干冰熔化破坏范德华力,故A符合题意;B. 乙酸汽化,C. 乙醇与丙酮混溶,D.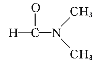 溶于水,均破坏范德华力和分子间氢键,故B、C、D不符合题意;E. 碘溶于四氯化碳,破坏范德华力,故E符合题意;F. 石英熔融破坏共价键,故F不符合题意;综上所述,答案为AE。
溶于水,均破坏范德华力和分子间氢键,故B、C、D不符合题意;E. 碘溶于四氯化碳,破坏范德华力,故E符合题意;F. 石英熔融破坏共价键,故F不符合题意;综上所述,答案为AE。
⑷A. N2含有非极性键的非极性分子,含有σ键和π键;B. CO2只含有极性键的非极性分子,含有σ键和π键;C. CH2Cl2只含有极性键的极性分子,只含有σ键;D. C2H4含有极性键、非极性键的非极性分子,含有σ键和π键;E.C2H6为含有极性键、非极性键的非极性分子,只含有σ键;F. CaCl2含有离子键,G. NH4Cl为含有离子键、极性键、配位键的离子化合物;因此只含有极性键的分子是BC,既含离子键又含共价键的化合物是G;只存在σ键的分子是CE,同时存在σ键和π键的分子是ABD;故答案为:BC;G;CE;ABD。
⑸同周期从左到右呈增大的趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族,因此第一电离能的大小:Mg>Al;镁离子半径小于钾离子半径,氧离子半径小于氯离子半径,因此熔点的高低:KCl<MgO;故答案为:>;<。

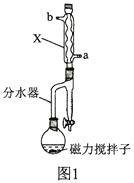
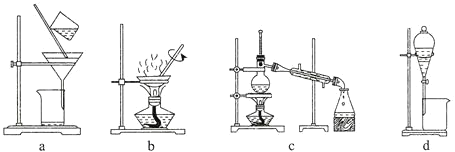
【题目】甲基丙烯酸甲酯的结构简式为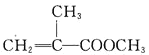 ,是有机玻璃的单体,其一种实验室制备方法如下:实验装置如图1所示(夹持装置及微波加热装置已略去):
,是有机玻璃的单体,其一种实验室制备方法如下:实验装置如图1所示(夹持装置及微波加热装置已略去):
实验步骤如下:
Ⅰ![]() 量取86ml甲基丙烯酸
量取86ml甲基丙烯酸![]()
![]() 置于烧杯中,在搅拌的同时加入5ml浓硫酸,冷却至室温,再加入50ml甲醇,搅拌,混合均匀;
置于烧杯中,在搅拌的同时加入5ml浓硫酸,冷却至室温,再加入50ml甲醇,搅拌,混合均匀;
Ⅱ![]() 将混合溶液注入图1装置的反应器中,加入磁力搅拌子,微波加热温度为105℃,持续加热,充分反应;
将混合溶液注入图1装置的反应器中,加入磁力搅拌子,微波加热温度为105℃,持续加热,充分反应;
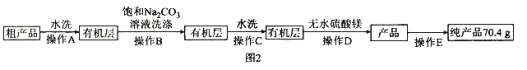
Ⅲ![]() 纯化产品,流程如图2所示:
纯化产品,流程如图2所示:
已知:
|
|
| |
溶解性 | 可溶于有机物、水 | 可溶于热水、酯 | 难溶于水、可溶于有机物 |
密度/gcm-3 | 0.79 | 1.01 | 0.94 |
沸点/℃ | 64.7 | 161 | 100~101 |
相对分子质量 | 32 | 86 | 100 |
回答下列问题:
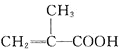
(1)制备甲基丙烯酸甲酯的化学方程式为______________________________。
(2)图1中仪器X的名称为________________,其进水口应为________________(填“a”或“b”)口。
(3)采用微波加热可准确控制反应温度和时间,若反应温度控制不好,可能有副产物产生,写出一种有机副产物的结构简式:_________。
(4)从分水器中及时分离出水的目的是_____________________,如果分水器中的水层不再增厚,则表明__________________________。
(5)纯化过程中,用“饱和碳酸钠溶液洗涤”的目的是_______________________________;完成操作C应选____________(填选项字母,下同)装置,完成操作D应选____________装置。
(6)本实验中甲基丙烯酸甲酯的产率为_________________![]() 保留三位有效数字
保留三位有效数字![]() 。
。
【题目】三氯胺(NCl3)是一种饮用水二级消毒剂,可由以下反应制备:
Ⅰ.![]()
![]()
回答下列问题:
(1)已知:Ⅱ.![]()
![]()
Ⅲ.![]()
![]()
则![]() =________(用含
=________(用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
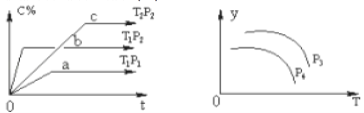
(2)向容积均为2L的甲乙两个恒温密闭容器中分别加入4mol NH3和4mol Cl2,发生反应Ⅰ,测得两容器中n(Cl2)随反应时间的变化情况如下表所示:
时间/min | 0 | 40 | 80 | 120 | 160 |
容器甲(T1) | 4.0 | 3.0 | 2.2 | 1.6 | 1.6 |
容器乙(T2) | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0~80min内,容器甲中v(NH3)=________________。
②反应Ⅰ的![]() ________0(填“>”或“<”),其原因为________________________。
________0(填“>”或“<”),其原因为________________________。
③关于容器乙,下列说法正确的是________
A.容器内![]() ,说明反应达到平衡状态
,说明反应达到平衡状态
B.反应进行到70min时,v正一定大于v逆
C.容器内气体平均相对分子质量在增大,说明平衡在正向移动
D.达平衡后,加入一定量NCl3(l),平衡逆向移动
E.达平衡后,按原投料比再充入一定量反应物,平衡后NH3的转化率增大
④温度为T1时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2L的恒压容器,平衡时容器中n(Cl2)________(填“>”、“=”或“<”)1.6mol。
⑤温度为T2时,该反应的平衡常数K=________。
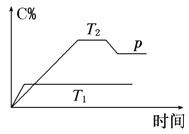
【题目】(1)将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
①在反应体系中加入催化剂,该反应的反应热_____(填“增大”、“减小”或“不变”)。
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率υ(N2)=___________,H2的转化率为_____________(保留小数点后一位)。
③欲提高②容器中H2的转化率,下列措施可行的是____________。
a.把气体的体积压缩至1L b.向容器中再充入惰性气体
c.改变反应的催化剂 d.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
4NH3(g)+3O2(g) ΔH=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a_________0。(填“大于”、“小于”或“等于”)
【题目】以硅藻土为载体的五氧化二钒![]() 是接触法生成硫酸的催化剂。从废钒催化剂中回收
是接触法生成硫酸的催化剂。从废钒催化剂中回收![]() 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 |
|
|
|
|
|
|
质量分数 |
|
|
|
|
|
|
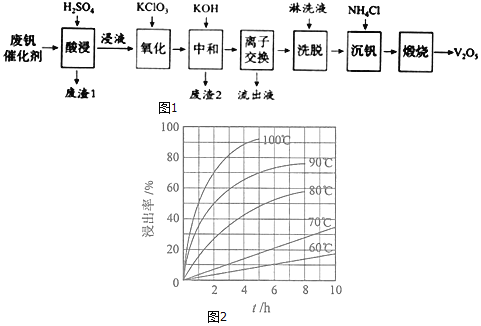
如图1是一种废钒催化剂回收工艺路线:
回答下列问题:
(1)“酸浸”时![]() 转化为
转化为![]() ,反应的离子方程式为______,同时
,反应的离子方程式为______,同时![]() 转成
转成![]() 为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有______
为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有______![]() 写出两条
写出两条![]() 。“废渣1”的主要成分是______。
。“废渣1”的主要成分是______。
(2)“酸浸”实验中,钒的浸出率结果如图2所示。由图可知,当钒的浸出率为![]() 时,所采用的实验条件为______。
时,所采用的实验条件为______。
(3)“氧化”中欲使3mol的![]() 变为
变为![]() ,则需要氧化剂
,则需要氧化剂![]() 至少为______mol。
至少为______mol。
(4)“中和”作用之一是使钒以![]() 形式存在于溶液中。“废渣2”中含有______。
形式存在于溶液中。“废渣2”中含有______。
(5)“离子交换”和“洗脱”可简单表示为:![]()
![]()
![]() 为强碱性阴离子交换树脂
为强碱性阴离子交换树脂![]() 。为了提高洗脱效率,淋洗液应该呈______性
。为了提高洗脱效率,淋洗液应该呈______性![]() 填“酸”、“碱”或“中”
填“酸”、“碱”或“中”![]() 。
。
(6)“流出液”中阳离子最多的是______。
(7)“沉钒”得到偏钒酸铵![]() 沉淀,写出“煅烧”中发生反应的化学方程式______。
沉淀,写出“煅烧”中发生反应的化学方程式______。