题目内容
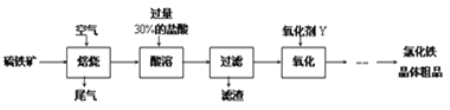
【题目】以黄铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
请按要求回答下列问题:
(1)需将硫铁矿粉碎再焙烧的目的是______________________________________.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是_____________、__________.
(3)尾气主要含N2、O2、SO2和少量的CO2、H2O(g).测定尾气中SO2含量的方案如下:
(方案甲)将标准状况下的2.24 L尾气缓慢通过如下装置A中:
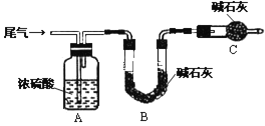
①C仪器的名称是_______________,装置C的作用是_________________________.
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量SO2的体积分数,请写出该方案合理与否的理由__________________________________________.
(方案乙)将标准状况下的2.24 L尾气缓慢通过如下装置D中,充分与足量试剂M反应后,再滴入过量试剂N,经过滤、洗涤、干燥、用电子天平称得沉淀质量为0.233g.
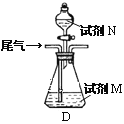
③若试剂M、N分别是碘水、BaCl2溶液,写出D中总反应的离子方程式: __________________.尾气中SO2的体积分数为__________________.
④若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色.写出SO2和Ba(NO3)2溶液反应的离子方程式:___________________________.
【答案】增大反应物的接触面积,加快反应速率 提高铁元素的浸出率 抑制Fe3+水解 球形干燥管 防止空气中的水蒸气、CO2进入B装置 该方案不合理,因为尾气中的CO2也能被B装置中的碱石灰吸收,导致所测SO2气体的体积分数偏大 SO2+I2+2H2O+ Ba2+=BaSO4↓+2I-+4H+ 1.00% 3SO2+3Ba2++2NO3-+2H2O = 3BaSO4↓+2NO+4H+
【解析】
(1)需将硫铁矿粉碎再焙烧的目的是矿石颗粒越小,与空气的接触面积越大,燃烧越充分。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是酸溶时可使反应充分,提高铁元素的浸出率;氧化时盐酸过量,可抑制Fe3+的水解。
(3)①C仪器的名称是球形干燥管,装置C的作用是防止空气中的水蒸气、CO2进入B装置,影响SO2含量的测定。
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量SO2的体积分数,该方案不合理,因为尾气中的CO2也能被碱石灰吸收。
③若试剂M、N分别是碘水、BaCl2溶液,D中发生的反应为SO2+I2+2H2O+BaCl2=BaSO4↓+2HI+2HCl,尾气中SO2的体积分数为 。
。
④若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色,则瓶内生成的气体为NO,SO2和Ba(NO3)2溶液反应的化学方程式为3SO2+3Ba(NO3)2+2H2O = 3BaSO4↓+2NO+4HNO3。
(1)需将硫铁矿粉碎再焙烧的目的是矿石颗粒越小,与空气的接触面积越大,燃烧越充分。答案为:增大反应物的接触面积,加快反应速率;
(2)酸溶及后续过程中均需保持盐酸过量,其目的是酸溶时可使反应充分,提高铁元素的浸出率;氧化时盐酸过量,可抑制Fe3+的水解。答案为:提高铁元素的浸出率;抑制Fe3+水解;
(3)①C仪器的名称是球形干燥管,装置C的作用是防止空气中的水蒸气、CO2进入B装置,影响SO2含量的测定。答案为:球形干燥管;防止空气中的水蒸气、CO2进入B装置;
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量SO2的体积分数,该方案不合理,因为尾气中的CO2也能被碱石灰吸收,导致所测SO2气体的体积分数偏大。答案为:该方案不合理,因为尾气中的CO2也能被B装置中的碱石灰吸收,导致所测SO2气体的体积分数偏大;
③若试剂M、N分别是碘水、BaCl2溶液,D中发生的反应为SO2+I2+2H2O+BaCl2=BaSO4↓+2HI+2HCl,反应的离子方程式为SO2+I2+2H2O+ Ba2+=BaSO4↓+2I-+4H+;尾气中SO2的体积分数为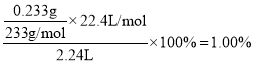 。答案为:SO2+I2+2H2O+ Ba2+=BaSO4↓+2I-+4H+;1.00%;
。答案为:SO2+I2+2H2O+ Ba2+=BaSO4↓+2I-+4H+;1.00%;
④若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色,则瓶内生成的气体为NO,SO2和Ba(NO3)2溶液反应的化学方程式为3SO2+3Ba(NO3)2+2H2O = 3BaSO4↓+2NO+4HNO3。答案为:3SO2+3Ba2++2NO3-+2H2O = 3BaSO4↓+2NO+4H+。

【题目】己知A、B、C、D、E、F、G都是周期表中前四周期的元素,他们的原子序数依次增大。其中A原子的L层有2个未成对电子。D是电负性最大的元素,E与F同主族,E的二价阳离子与C的阴离子具有相同的电子层结构。G3+离子3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的順序为______________________。D的核外有______________种运动状态不同的电子。
(2)A的最简单氢化物属于___________(填“极性分子”和“非极性分子”)。![]() 离子空间构型是__________,其中心原子采取__________________杂化。
离子空间构型是__________,其中心原子采取__________________杂化。
(3)晶体熔点:EC_________FC(填“>”、“<”或“=”)
(4)G和M(质子数为25)两元素的部分电离能数据列于表:
元素 | M | G | |
电离能(kJmol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态G2+再失去一个电子难。其原因是_________________________________________。
【题目】二甲醚被称为“21世纪的清洁燃料”。利用甲醇脱水可制得二甲醚。反应方程式如下:2CH3OH(g)≒CH3OCH3(g)+H2O(g) ΔH1
(1) 二甲醚亦可通过合成气反应制得,相关热化学方程式如下:2H2(g)+CO(g)≒CH3OH(g) ΔH2
CO(g)+H2O(g)≒CO2(g)+H2(g) ΔH3 3H2(g)+3CO(g)≒CH3OCH3(g) +CO2(g) ΔH4
则ΔH1=__________________(用含有ΔH2、ΔH3、ΔH4的关系式表示).
(2)经查阅资料,上述甲醇脱水反应平衡常数Kp的计算式为lnKp= - 2.205+(2708.6137/T) (Kp为以分压表示的平衡常数,T为热力学温度),且催化剂吸附H2O(g)的量会受压强影响,从而进步影响催化效率。
①在一定温度范围内,随温度升高,CH3OH(g)脱水转化为CH3OCH3(g)的倾向__________ (填“增大”、“不变”或“减小”),ΔH4________2ΔH2+ΔH3 (填“>”、<”或“=”)。
物质 | CH3OH | CH3OCH3 | H2O |
分压/MPa | 0.50 | 0.50 | 0.50 |
②某温度下(此时Kp=100),在密闭容器中加入一定量CH3OH,某时刻测得各组分的压如下:
此时正、逆反应速率的大小:V正____V逆(填“>”、“<”或“=”)。

③200℃时,在密闭容器中加入一定量CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为__________(填序号).
A.< 1/3 B.1/3 C.1/3~1/2 D.1/2 E.> 1/2
④300℃时,使CH3OH(g)以一定流速通过催化剂,V/F(按原料流率的催化剂量)、压强对甲醇转化率影响如图1所示。请简述在上述条件下,压强对甲醇转化率影响的规律,并解释变化原因__________。
(3)直接二甲醚燃料电池有望大规模商业化应用,工作原理如图2所示。
①负极的电极反应式为__________。
②现利用该电池电解CuC12溶液,当消耗2.3g二甲醚时,电解所得铜的质量为_________g(设电池的能量利用率为50%)。
【题目】实验室模拟工业生产食品香精菠萝酯(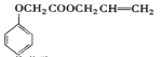 )的简易流程如下:
)的简易流程如下:
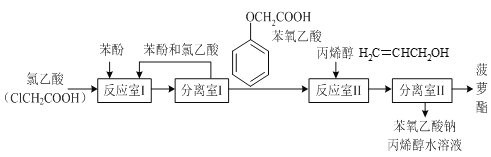
有关物质的熔、沸点如表:
苯酚 | 氯乙酸 | 苯氧乙酸 | |
熔点/℃ | 43 | 62 | 99 |
沸点/℃ | 181.9 | 189 | 285 |
试回答下列问题:
(1)反应室I中反应的最佳温度是104℃,为较好地控制温度在102℃~106℃之间,加热时可选用___(选填字母)。
A.火炉直接加热 B.水浴加热 C.油浴加热
(2)分离室I采取的操作名称是___。
(3)反应室I中发生反应的化学方程式是___。
(4)分离室II的操作为:①用NaHCO3溶液洗涤后分液;②有机层用水洗涤后分液;洗涤时不能用NaOH溶液代替NaHCO3溶液,其原因是___(用化学方程式表示)。