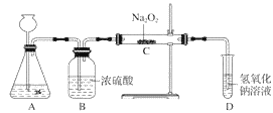
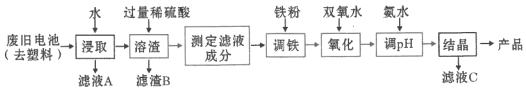
题目内容
【题目】有物质的量浓度均为0.1mo/L的下列溶液:
(1)①NH3·H2O ②FeCl2 ③NaHSO4 ④KOH ⑤Ba(OH)2 ⑥H2SO4,其pH由大到小的顺序排列的是(填序号)___。
(2)写出氯化亚铁溶液中,亚铁离子水解的离子方程式___。
(3)写出硫酸氢钠与氢氧化钡2:1反应的离子方程式___。
(4)将氢氧化钾与氯化亚铁溶液混合,现象___。依次发生的化学方程式____、___。
(5)氯化亚铁保存时为何加少量铁粉___,若保存硫酸铁溶液时应向溶液中加入____。
(6)如何利用氯水和硫氰化钾检验氯化亚铁溶液中的Fe2+,写出加入试剂的先后顺序和对应现象__。
【答案】⑤④①②③⑥ Fe2++ 2H2O![]() 2Fe(OH)2+ 2H+ Ba2++ 2H++SO42- + 2OH- == BaSO4↓ + 2H2O 先生成白色沉淀,后迅速变灰绿色,最终变为红褐色 2KOH+ FeCl2 == Fe(OH)2 ↓+ 2KCl 4Fe(OH)2+ O2+ 2H2O==4Fe(OH)3 防止亚铁离子被氧化 稀硫酸 取少溶液于试管,向试管中加入KSCN,无现象,再向溶液中滴加少量氯水,溶液变为红色,则溶液中含有Fe2+
2Fe(OH)2+ 2H+ Ba2++ 2H++SO42- + 2OH- == BaSO4↓ + 2H2O 先生成白色沉淀,后迅速变灰绿色,最终变为红褐色 2KOH+ FeCl2 == Fe(OH)2 ↓+ 2KCl 4Fe(OH)2+ O2+ 2H2O==4Fe(OH)3 防止亚铁离子被氧化 稀硫酸 取少溶液于试管,向试管中加入KSCN,无现象,再向溶液中滴加少量氯水,溶液变为红色,则溶液中含有Fe2+
【解析】
⑴①NH3·H2O ②FeCl2 ③NaHSO4 ④KOH ⑤Ba(OH)2 ⑥H2SO4,六者显酸性的有③NaHSO4,②FeCl2,⑥H2SO4,⑥H2SO4酸性更强,③NaHSO4,电离显强酸性,但比硫酸酸性弱,②FeCl2是水解显酸性,酸性较弱,三者pH从大到小依次②FeCl2,③NaHSO4,⑥H2SO4,六者显碱性的有①NH3·H2O,④KOH,⑤Ba(OH)2,其中④KOH,⑤Ba(OH)2是强碱电离显碱性,且氢氧化钡电离出的氢氧根多,碱性更强,①NH3·H2O是弱电解质,电离显弱碱性,故三者pH从大到小顺序为⑤Ba(OH)2,④KOH,①NH3·H2O,因此六者pH从大到小顺序为⑤④①②③⑥;
⑵氯化亚铁溶液中,亚铁离子水解的离子方程式Fe2++ 2H2O![]() 2Fe(OH)2+ 2H+,故答案为Fe2++ 2H2O
2Fe(OH)2+ 2H+,故答案为Fe2++ 2H2O![]() 2Fe(OH)2+ 2H+;
2Fe(OH)2+ 2H+;
⑶假设2 mol硫酸氢钠溶液中电离出2 mol 氢离子、2 mol硫酸根离子、2 mol钠离子
1 mol氢氧化钡溶液电离出1 mol钡离子、2 mol氢氧根离子,因此分析得出氢氧根和氢离子反应完,硫酸根只反应了1 mol,故离子方程式为Ba2++ 2H++SO42- + 2OH- == BaSO4 ↓+ 2H2O;故答案为Ba2++ 2H++SO42- + 2OH- == BaSO4↓+ 2H2O;
⑷将氢氧化钾与氯化亚铁溶液混合,现象先生成白色沉淀,后迅速变灰绿色,最终变为红褐色,依次发生的化学方程式2KOH+ FeCl2 == Fe(OH)2 ↓+ 2KCl、4Fe(OH)2+ O2+ 2H2O==4Fe(OH)3,故答案为先生成白色沉淀,后迅速变灰绿色,最终变为红褐色;2KOH+ FeCl2 == Fe(OH)2 ↓+ 2KCl、4Fe(OH)2+ O2+ 2H2O==4Fe(OH)3;
⑸氯化亚铁保存时为何加少量铁粉防止亚铁离子被氧化,若保存硫酸铁溶液时应向溶液中加入稀硫酸以防止其发生水解,故答案为防止亚铁离子被氧化;稀硫酸;
⑹利用氯水和硫氰化钾检验氯化亚铁溶液中的Fe2+,加入试剂的先后顺序和对应现象为:取少溶液于试管,向试管中加入KSCN,无现象,再向溶液中滴加少量氯水,溶液变为红色,则溶液中含有Fe2+。故答案为:取少溶液于试管,向试管中加入KSCN,无现象,再向溶液中滴加少量氯水,溶液变为红色,则溶液中含有Fe2+。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】钒是地壳中含量第21丰富元素,是人体必需的微量元素,对治疗糖尿病和癌症及保护心血管等具有潜在的药理学作用。工业上用含三价钒![]() 为主的某石煤为原料(含有
为主的某石煤为原料(含有![]() 、CaO等杂质),钙化法焙烧制备
、CaO等杂质),钙化法焙烧制备![]() ,其流程如下:
,其流程如下:
![]()
已知:+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 |
|
|
|
|
(1)焙烧:向石煤中加生石灰焙烧,将![]() 转化为
转化为![]() 的化学方程式是________________。
的化学方程式是________________。
(2)酸浸:![]() 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的![]() ,
,![]() 溶于盐酸的离子方程式是________________。
溶于盐酸的离子方程式是________________。
(3)转沉:将浸出液中的钒转化为![]() 固体,其流程如下:
固体,其流程如下:
![]()
①浸出液中加入石灰乳的作用是____________________________________。
②向![]() 溶液中加入
溶液中加入![]() 溶液,控制溶液的
溶液,控制溶液的![]() 。当
。当![]() 时,
时,![]() 的产量明显降低,原因是_______________________________________。
的产量明显降低,原因是_______________________________________。
(4)实验室以![]() 为原料还可以合成用于制备
为原料还可以合成用于制备![]() 的氧钒(IV)碱式碳酸铵晶体,过程如下:
的氧钒(IV)碱式碳酸铵晶体,过程如下:
![]()
①步骤ⅱ可在如图装置(气密性良好)中进行。已知:![]() 能被
能被![]() 氧化。
氧化。
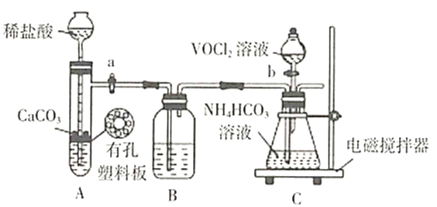
药品填装完成后的实验操作是________(填“活塞a”、“活塞b”的操作顺序),装置B中的试剂是________。
②测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加![]() 的
的![]() 溶液至稍过量,充分反应后继续加1%
溶液至稍过量,充分反应后继续加1%![]() 溶液至稍过量,再用尿素除去过量的
溶液至稍过量,再用尿素除去过量的![]() ,最后用
,最后用![]() 的
的![]() 标准溶液滴定至终点,消耗体积为30.00mL(滴定反应:
标准溶液滴定至终点,消耗体积为30.00mL(滴定反应: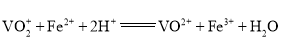 )。
)。
![]() 溶液的作用是________________,粗产品中钒的质量分数为________________(精确到小数点后两位)。
溶液的作用是________________,粗产品中钒的质量分数为________________(精确到小数点后两位)。