��Ŀ����
����Ŀ�����ǵؿ��к�����21�ḻԪ�أ�������������Ԫ�أ����������Ͱ�֢��������Ѫ�ܵȾ���DZ�ڵ�ҩ��ѧ���á���ҵ���ú����۷�![]() Ϊ����ijʯúΪԭ��(����
Ϊ����ijʯúΪԭ��(����![]() ��CaO������)���ƻ��������Ʊ�
��CaO������)���ƻ��������Ʊ�![]() �����������£�
�����������£�
![]()
��֪��+5�۷�����Һ�е���Ҫ������ʽ����ҺpH�Ĺ�ϵ���±���
pH | 4~6 | 6~8 | 8~10 | 10~12 |
��Ҫ���� |
|
|
|
|
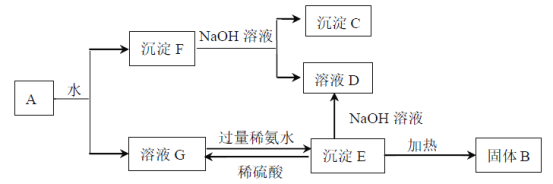
(1)���գ���ʯú�м���ʯ�ұ��գ���![]() ת��Ϊ
ת��Ϊ![]() �Ļ�ѧ����ʽ��________________��
�Ļ�ѧ����ʽ��________________��
(2)�����![]() ������ˮ�����������ᡣ����ɰ���ʱ��Һ��
������ˮ�����������ᡣ����ɰ���ʱ��Һ��![]() ��
��![]() ������������ӷ���ʽ��________________��
������������ӷ���ʽ��________________��
(3)ת����������Һ�еķ�ת��Ϊ![]() ���壬���������£�
���壬���������£�
![]()
�ٽ���Һ�м���ʯ�����������____________________________________��
����![]() ��Һ�м���
��Һ�м���![]() ��Һ��������Һ��
��Һ��������Һ��![]() ����
����![]() ʱ��
ʱ��![]() �IJ������Խ��ͣ�ԭ����_______________________________________��
�IJ������Խ��ͣ�ԭ����_______________________________________��
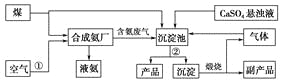
(4)ʵ������![]() Ϊԭ�ϻ����Ժϳ������Ʊ�
Ϊԭ�ϻ����Ժϳ������Ʊ�![]() ������(IV)��ʽ̼��茶��壬�������£�
������(IV)��ʽ̼��茶��壬�������£�
![]()
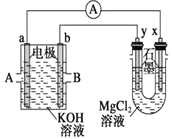
�ٲ�����������ͼװ��(����������)�н��С���֪��![]() �ܱ�
�ܱ�![]() ������
������
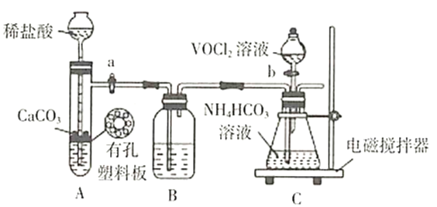
ҩƷ��װ��ɺ��ʵ�������________(��������a����������b���IJ���˳��)��װ��B�е��Լ���________��
�ڲⶨ����(IV)��ʽ̼��茶���ֲ�Ʒ�з��ĺ�����
����4.246g��Ʒ����ƿ�У���20mL����ˮ��30mL�������ܽ��![]() ��
��![]() ��Һ���Թ�������ַ�Ӧ�������1%
��Һ���Թ�������ַ�Ӧ�������1%![]() ��Һ���Թ������������س�ȥ������
��Һ���Թ������������س�ȥ������![]() �������
�������![]() ��
��![]() ����Һ�ζ����յ㣬�������Ϊ30.00mL(�ζ���Ӧ��
����Һ�ζ����յ㣬�������Ϊ30.00mL(�ζ���Ӧ��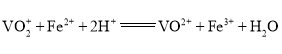 )��
)��
![]() ��Һ��������________________���ֲ�Ʒ�з�����������Ϊ________________(��ȷ��С�������λ)��
��Һ��������________________���ֲ�Ʒ�з�����������Ϊ________________(��ȷ��С�������λ)��
���𰸡�CaO+O2+V2O3![]() Ca(VO3)2 Ca(VO3)2+4H+=2VO2++Ca2++2H2O ������Һ��pH�����ṩ
Ca(VO3)2 Ca(VO3)2+4H+=2VO2++Ca2++2H2O ������Һ��pH�����ṩ![]() ���γ�
���γ�![]() ���� ��
���� ��![]() ʱ��������Ҫ������ʽ����
ʱ��������Ҫ������ʽ����![]() ����a�����Ӻ��ٴ���b ����
����a�����Ӻ��ٴ���b ����![]() ��Һ ��ȥ������
��Һ ��ȥ������![]() 2.88%
2.88%
��������
�������̣���ʯú�м���ʯ�ұ��գ�������Ҫ��Ӧ��CaO+O2+V2O3![]() Ca(VO3)2�����������������Һ��ʯ����õ�Ca3(VO4)2����������Ԫ�أ����������(NH4)2CO3��Һ�õ�(NH4)3VO4��Һ����(NH4)3VO4��Һ�м���NH4CI��Һ��������Һ��pH=7.5���õ�NH4VO3�������Ƶ�V2O5���Ƶõ�V2O5�����ᡢN2H42HCl��Ϸ�����Ӧ��2V2O5+N2H42HCl+6HCl=4VOCl2+N2��+6H2O���õ�VOCl2��Һ������NH4HCO3��Һ���õ�������������ʽ̼��茶��壬�ݴ˷������
Ca(VO3)2�����������������Һ��ʯ����õ�Ca3(VO4)2����������Ԫ�أ����������(NH4)2CO3��Һ�õ�(NH4)3VO4��Һ����(NH4)3VO4��Һ�м���NH4CI��Һ��������Һ��pH=7.5���õ�NH4VO3�������Ƶ�V2O5���Ƶõ�V2O5�����ᡢN2H42HCl��Ϸ�����Ӧ��2V2O5+N2H42HCl+6HCl=4VOCl2+N2��+6H2O���õ�VOCl2��Һ������NH4HCO3��Һ���õ�������������ʽ̼��茶��壬�ݴ˷������
(1)���գ���ʯú�м���ʯ�ұ��գ�V2O3��CaO���������յõ�Ca(VO3)2����ӦΪ��CaO+O2+V2O3![]() Ca(VO3)2��
Ca(VO3)2��
(2)���ݱ���֪��pH=4��Ca(VO3)2������������VO2+��������ӷ�ӦΪ��Ca(VO3)2+4H+=2VO2++Ca2++2H2O��
(3)�ٽ���Һ�м���ʯ����������ǵ���pH�����ṩCa2+���γ�Ca3(VO4)2����(������Ԫ��)��
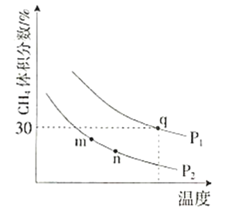
�ڸ���ͼ����֪��pH��8ʱ��������Ҫ������ʽ����VO3���ʵ�pH��8ʱ��NH4VO3�IJ������Խ��ͣ�
(4)����֪��![]() �ܱ�
�ܱ�![]() ��������װ���в����п��������ԣ���Ӧǰ��ͨ�������̼�������ų�װ���еĿ�����������ﱻ��������ҩƷ��װ��ɺ��ʵ������ǣ�����a�����Ӻ��ٴ���b��A���ƵõĶ�����̼����HCl���壬Bװ�õ��Լ�Ӧ��������HCl����ͬʱ�����ն�����̼����Ϊ����NaHCO3��Һ��
��������װ���в����п��������ԣ���Ӧǰ��ͨ�������̼�������ų�װ���еĿ�����������ﱻ��������ҩƷ��װ��ɺ��ʵ������ǣ�����a�����Ӻ��ٴ���b��A���ƵõĶ�����̼����HCl���壬Bװ�õ��Լ�Ӧ��������HCl����ͬʱ�����ն�����̼����Ϊ����NaHCO3��Һ��
�ڸ���ʵ�������������������Һ����������������![]() ��Һ�������dz�ȥ������KMnO4����֪�ζ���Ӧ��
��Һ�������dz�ȥ������KMnO4����֪�ζ���Ӧ�� ���ɷ�Ӧ�ɵã�n(
���ɷ�Ӧ�ɵã�n(![]() )=n(Fe2+)=30��10-3L��0.08mol/L=2.4��10-3mol�����ݷ��غ㣬��ֲ�Ʒ�з������ʵ���ҲΪ2.4��10-3mol������������Ϊ
)=n(Fe2+)=30��10-3L��0.08mol/L=2.4��10-3mol�����ݷ��غ㣬��ֲ�Ʒ�з������ʵ���ҲΪ2.4��10-3mol������������Ϊ![]() ��100%=2.88%��
��100%=2.88%��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�