题目内容
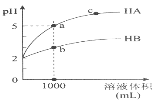
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①②③
实验编号 | HA物质的量浓度/mol L-1 | NaOH物质的量浓度/moL- 1 | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请同答:
(1)根据①组实验情况,分析混合溶液的pH=9的原因是(用反应的离子方程式表示)___________________________
(2)在①组游液中下列关系式不正确的是(填序号字母)_______
A.c(Na+)+(H+)=c(OH-) +c(A-)
B.c(Na+ )=c(HA) +c(A-)
C.c(HA)+c(H+)=c(OH-)+c(Na+)
D. c(Na+)+(H+)=c(OH-) +c(A-)+c(HА)
(3)②组情况表明.c __________0.2 mol L-1(选填“> "、"<"或"="),混合溶液中离子浓度c(A-)________________c(Na+ )(选填“>"、"<"或=")
(4)从③组实验结果分析,说明HA的电离程度__________NaA的水解程度(选填“>"、“<"或“="),离子浓度由大到小的顺序是_____________________________________________
【答案】A-+H2O![]() HA+OH- CD > = 大于 c(A-)>c(Na+)>c(H+)>c(OH-)
HA+OH- CD > = 大于 c(A-)>c(Na+)>c(H+)>c(OH-)
【解析】
(1)等体积等浓度的氢氧化钠与HA混合,恰好生成NaA,溶液显示碱性,说明NaA为强碱弱酸盐,A-水解导致溶液显示碱性;
(2)根据电荷守恒、物料守恒比较溶液中各离子浓度之间的关系;
(3)根据c=0.2mol·L-1时,溶液显示碱性,则加入的HA的物质的量应该稍大,则c应该大于0.2mol·L-1;
根据溶液的pH=7及电荷守恒可知钠离子与A-的浓度相等;
(4)由③组实验结果可知,混合后为HA与NaA的混合液,pH<7,酸的电离大于盐的水解,并由离子的浓度比较大小.
(1)等体积等浓度混合,恰好生成正盐,溶液的pH=9,则生成强碱弱酸盐,所以HA为弱酸,A-水解导致溶液显示碱性,水解方程式为:H2O+A-![]() HA+OH-;
HA+OH-;
(2)A.根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(A-),故A正确;
B.根据物料守恒可知:c(Na+)=c(HA)+c(A-),故B正确;
C.由电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-)、物料守恒c(Na+)=c(HA)+c(A-)可知,c(HA)+c(H+)=c(OH-),故C错误;
D.由电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-)可知,c(Na+)+c(H+)<c(OH-)+c(A-)+c(HA),故D错误;
故选CD;
(3)若酸为强酸,等体积等浓度混合时pH=7;而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度大于0.2mol·L-1;
由电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),c(H+)=c(OH-),则c(A-)=c(Na+);
(4)由③组实验结果可知,混合后为HA与NaA的混合液,pH<7,酸的电离大于盐的水解,电离显酸性,c(H+)>c(OH-),电离大于水解,则c(A-)>c(Na+)>c(H+)>c(OH-)。

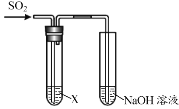
【题目】某学习小组用下图装置研究SO2的性质。
| 序号 | X | 实验现象 |
Ⅰ | 紫色石蕊溶液 | 现象a | |
Ⅱ | 品红溶液 | 溶液由红色变为无色,加热后又恢复原来的颜色 | |
Ⅲ | 酸性KMnO4溶液 | 溶液由紫色变为无色 |
请回答:
(1)实验Ⅰ中,现象a是______。
(2)根据实验Ⅱ,推断SO2的化学性质是______。
(3)根据实验Ⅲ,推断无色溶液中所含的离子是K+、Mn2+、H+和______。
(4)结合离子方程式说明实验中NaOH溶液的作用是______。