题目内容
8.下列几种情况使中和滴定结果偏低的是( )| A. | 盛待测液的锥形瓶用蒸馏水洗后未用待测液润洗 | |
| B. | 滴定管尖嘴部分在滴定前有气泡 | |
| C. | 滴定管在滴定前未将刻度调在“0.00”,而调在“2.40” | |
| D. | 滴定达终点时,滴定管尖嘴部分有气泡 |
分析 A、盛装待测液的锥形瓶不能用待测液润洗;
B、滴定管尖嘴部分在滴定前有气泡,会导致所读取的消耗的标准液的体积偏大;
C、调整液面后,液面要在0或0刻度以下即可;
D、达滴定终点时,滴定管尖嘴部分有气泡,则所读取的消耗的标准液的体积偏小.
解答 解:A、盛装待测液的锥形瓶不能用待测液润洗,故锥形瓶未用待测液润洗是正确的,对结果无影响,故A错误;
B、滴定管尖嘴部分在滴定前有气泡,会导致所读取的消耗的标准液的体积偏大,则计算出的待测液的浓度偏高,故B错误;
C、调整液面后,液面要在0或0刻度以下即可,故未将刻度调在“0.00”,而调在“2.40”完全可以,对待测液的浓度无影响,故C错误;
D、达滴定终点时,滴定管尖嘴部分有气泡,则所读取的消耗的标准液的体积偏小,则计算出的待测液的浓度偏低,故D正确.
故选D.
点评 本题考查了中和滴定中的误差分析,注意锥形瓶不能润洗,滴定管必须润洗,本题难度不大,注意操作的规范性和掌握实验中常见的误差分析技巧.

练习册系列答案
相关题目
3.由两种烃组成的混合气体2L与足量的氧气充分反应后生成5LCO2、6LH2O(所有体积都在120℃测定),则这两种混合气体的可能组成是( )
| A. | C2H4、C3H8 | B. | CH4、C3H8 | C. | CH4、C4H10 | D. | C2H2、C3H8 |
13.半导体工业用石英砂做原料通过三个重要反应生产单质硅:
①SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+682.44kJ•mol-1,
(石英砂) (粗硅)
②Si(s)+2Cl2(g)═SiCl4(g)△H=-657.01kJ•mol-1
③SiCl4(g)+2Mg(s)═2MgCl2(s)+Si(s)△H=-625.63kJ•mol-1
(纯硅)
用石英砂生产1.00kg纯硅的总放热为( )
①SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+682.44kJ•mol-1,
(石英砂) (粗硅)
②Si(s)+2Cl2(g)═SiCl4(g)△H=-657.01kJ•mol-1
③SiCl4(g)+2Mg(s)═2MgCl2(s)+Si(s)△H=-625.63kJ•mol-1
(纯硅)
用石英砂生产1.00kg纯硅的总放热为( )
| A. | 2.43×104 kJ | B. | 2.35×104 kJ | C. | 2.23×104 kJ | D. | 2.14×104 kJ |
20.已知A(g)+B(g)═C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
①该反应的平衡常数表达式K=$\frac{c(C)×c(D)}{c(A)×c(B)}$,△H>0(填“<”、“>”或“=”);
②830℃时,向一个5L的密闭容器中充入0.20mol的A和0.60mol的B,若反应经一段时间后,达到平衡时A的转化率为75%.如果这时向该密闭容器中再充入1molA气体,平衡向右移动(填“左”、“右”或“不移动”).平衡时A的转化率减小;(填“增大”、“减小”或“不变”).
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.6 |
①该反应的平衡常数表达式K=$\frac{c(C)×c(D)}{c(A)×c(B)}$,△H>0(填“<”、“>”或“=”);
②830℃时,向一个5L的密闭容器中充入0.20mol的A和0.60mol的B,若反应经一段时间后,达到平衡时A的转化率为75%.如果这时向该密闭容器中再充入1molA气体,平衡向右移动(填“左”、“右”或“不移动”).平衡时A的转化率减小;(填“增大”、“减小”或“不变”).
17.如图图示装置的实验中,操作正确的是( )
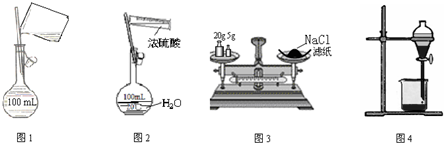

| A. | 图1配制250mL0.10mol•L-1盐酸 | B. | 图2稀释浓硫酸 | ||
| C. | 图3称量氯化钠固体 | D. | 图4CCl4萃取碘水的分液操作 |
18.原电池工作时能量转化的主要形式是( )
| A. | 化学能转化为电能 | B. | 电能转化为化学能 | ||
| C. | 化学能转化为热能 | D. | 化学能转化为光能 |
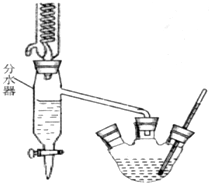 已知苯甲酸乙酯的沸点为213℃(在此温度以下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出).请回答上述实验室制备苯甲酸乙酯的有关问题:
已知苯甲酸乙酯的沸点为213℃(在此温度以下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出).请回答上述实验室制备苯甲酸乙酯的有关问题: 某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程:
某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程: ,试写出:
,试写出: .
. .
. .
. ,
,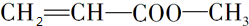 ,
,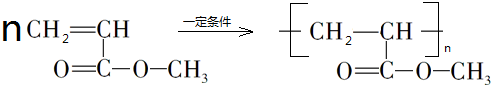 .
.