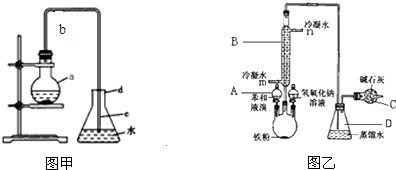
题目内容
19. 某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程:
某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程:1、反应原理:NaHSO3首先和KIO3反应先产生碘离子,NaHSO3消耗完碘离子再和过量的KIO3溶液反应生成I2.在实验的过程中,发现当NaHSO3完全消耗即有I2析出,即淀粉变蓝.请写出此反应过程的离子方程式:3HSO3-+IO3-=I-+SO42-+3H+、IO3-+5I-+6H+=3I2+3H2O.
2、探究温度对化学反应速率的影响:
已知NaHSO3溶液在不同温度下均可被过量KIO3氧化,根据I2析出所需时间可以求得NaHSO3的反应速率.实验如下:将浓度均为0.020mol•L-1NaHSO3(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图所示.据图分析讨论:
(1)兴趣小组对于55℃时未观察到溶液变蓝原因进行了猜测:
假设一:此温度下,亚硫酸氢钠分解;
假设二:没有生成单质碘;
假设三:淀粉变质;
…
(2)由图分析:温度的变化与溶液变蓝时间的关系是:40℃以前,温度越高,反应速率越快,40℃后温度越高,变色时间越长,反应速率越慢.
(3)图中b、c两点对应的NaHSO3反应速率为v(b)小于v(c)(填大于、小于或等于).
(4)图中a点对应的NaHSO3反应平均速率为5.0×10-5mol•L-1•s-1.
(5)根据图象分析,你认为淀粉能否作为检验碘单质的试剂?简述理由:温度高于40℃时,淀粉易糊化,不宜在高于40℃的条件下作指示剂..
分析 1、首先NaHSO3被氧化为SO42-,同时KIO3被还原为碘离子,其次过量的KIO3和碘离子发生归中反应生成单质碘,根据电子得失守恒以及质量守恒判断;
2、(1)55℃时未观察到溶液变蓝还可能是没有单质碘,或者淀粉变质来分析;
(2)由图象可知,40℃之前温度越高溶液变蓝所需要的时间越短;40℃之后温度越高溶液变蓝所需要的时间越长,其变化趋势相反;
(3)b、c点对应的温度不同;
(3)根据V=$\frac{△c}{△t}$来解答;
(4)温度高于40℃时,淀粉易糊化;
解答 解:1、NaHSO3被氧化为SO42-,同时KIO3被还原为碘离子,其反应的离子方程式为:3HSO3-+IO3-=I-+SO42-+3H+;过量的KIO3和碘离子发生归中反应生成单质碘,其反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O;
故答案为:5HSO3-+2IO3-=I2+5SO42-+3H++H2O;IO3-+5I-+6H+=3I2+3H2O;
2、(1)55℃时未观察到溶液变蓝还可能是没有单质碘,或者淀粉变质;
故答案为:没有生成单质碘;淀粉变质;
(2)从图象中可以看出,40℃以前,温度越高,反应速率越快,40℃后温度越高,变色时间越长,反应速率越慢,其变化趋势相反;
故答案为:40℃以前,温度越高,反应速率越快,40℃后温度越高,变色时间越长,反应速率越慢,其变化趋势相反;
(3)由图中b、c反应时间相同、温度不同可知,温度高反应速率快,故反应速率不同;
故答案为:小于;
(4)a点时间为80s,浓度变化量为$\frac{0.02mol/L×0.01L}{0.05L}$=0.004mol/L,a点对应的NaHSO3反应速率为V=$\frac{0.004mol/L}{80s}$=5.0×10-5mol•L-1•s-1;
故答案为:5.0×10-5mol•L-1•s-1;
(5)温度高于40℃时,淀粉易糊化,故淀粉不宜在高于40℃的条件下作指示剂;
故答案为:温度高于40℃时,淀粉易糊化,不宜在高于40℃的条件下作指示剂.
点评 本题考查化学反应速率的影响因素,侧重图象分析及温度对反应的影响,注意不同温度下均可被过量KIO3氧化,注重分析能力和解决问题能力的考查,题目难度较大.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| t/min | 2 | 4 | 7 | 9 |
| n(I2)/mol | 0.012 | 0.011 | 0.010 | 0.010 |
(1)2min内,v(H2)=0.002mol/(L•min).
(2)下列能证明该反应已经达到平衡的是BC.
A.v正(H2)=v逆(HI) B.混合气体的颜色不再发生变化
C.混合气体中各组分的物质的量不再发生变化 D.混合气体的密度不再发生变化
(3)该温度下反应的化学平衡常数的数值是1.44.
(4)H2的平衡转化率是37.5%.
(5)温度降低时,该反应的平衡常数增大,则正反应是放热.(填“放热”或“吸热”)反应.
(6)一定可以提高平衡体系中HI百分含量的措施是A.
A.降低高温度 B.增大H2浓度 C.加入催化剂 D.降低压强.
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6~10的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反应至6min时,c(H2O2)=0.20mol/L | |
| D. | 反应至6min时,H2O2分解了40% |
| A. | 盛待测液的锥形瓶用蒸馏水洗后未用待测液润洗 | |
| B. | 滴定管尖嘴部分在滴定前有气泡 | |
| C. | 滴定管在滴定前未将刻度调在“0.00”,而调在“2.40” | |
| D. | 滴定达终点时,滴定管尖嘴部分有气泡 |
| A. | 3种 | B. | 4种 | C. | 8种 | D. | 6种 |