题目内容
3.由两种烃组成的混合气体2L与足量的氧气充分反应后生成5LCO2、6LH2O(所有体积都在120℃测定),则这两种混合气体的可能组成是( )| A. | C2H4、C3H8 | B. | CH4、C3H8 | C. | CH4、C4H10 | D. | C2H2、C3H8 |
分析 同温同压下,气体的体积之比等于物质的量之比,可得混合气体的最简式为C2.5H6,根据C原子可计算混合气体的物质的量之比,然后根据所求得的物质的量之比计算H原子数是否为7,据此进行判断.
解答 解:同温同压下,气体的体积之比等于物质的量之比,可得混合气体的最简式为C2.5H6,
A.当C=2.5时,两种烃的物质的量之比为1:1,含H原子数为6,不符合条件,故A正确;
B.当C=2.5时,两种烃的物质的量之比为5:3,含H原子数为5.5,不符合条件,故B错误;
C.当C=2.5时,两种烃的物质的量之比为1:1,含H原子数为6,不符合条件,故C错误;
D.当C=2.5时,两种烃的物质的量之比为1:1,含H原子数为7,符合条件,故D错误;
故选A.
点评 本题考查混合物的计算,题目难度中等,本意不能直接用最简式排除,应根据C的平均原子数计算H的平均原子数进行排除计算,试题培养了学生的化学计算能力.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
13.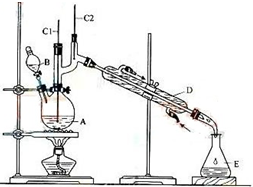 正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
CH3CH2CH2CH2O$→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$HCH3CH2CH2CHO
反应物和产物的相关数据列表如下:
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A
中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,简述理由不能,浓硫酸溶于水放出大量热,容易发生迸溅伤人.
(2)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(3)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润洗b.干燥 c.查漏
(4)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,促使反应正向进行,又可尽量避免其被进一步氧化.
(5)正丁醇的同分异构体有许多种,请写出符合下列条件的正丁醇的同分异构体:(1)含有与正丁醇相同的官能团;(2)一定条件下能被氧化成醛.(CH3)2CHCH2OH
(6)本实验中正丁醛的产率为51%.
 正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2O$→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$HCH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/.c | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A
中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,简述理由不能,浓硫酸溶于水放出大量热,容易发生迸溅伤人.
(2)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(3)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润洗b.干燥 c.查漏
(4)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,促使反应正向进行,又可尽量避免其被进一步氧化.
(5)正丁醇的同分异构体有许多种,请写出符合下列条件的正丁醇的同分异构体:(1)含有与正丁醇相同的官能团;(2)一定条件下能被氧化成醛.(CH3)2CHCH2OH
(6)本实验中正丁醛的产率为51%.
14.在一定的温度下,1L的密闭容器中通入H2和I2各0.016mol,发生如下反应:H2(g)+I2(g)?2HI(g).一段时间后达到平衡,测得数据如下:
请回答:
(1)2min内,v(H2)=0.002mol/(L•min).
(2)下列能证明该反应已经达到平衡的是BC.
A.v正(H2)=v逆(HI) B.混合气体的颜色不再发生变化
C.混合气体中各组分的物质的量不再发生变化 D.混合气体的密度不再发生变化
(3)该温度下反应的化学平衡常数的数值是1.44.
(4)H2的平衡转化率是37.5%.
(5)温度降低时,该反应的平衡常数增大,则正反应是放热.(填“放热”或“吸热”)反应.
(6)一定可以提高平衡体系中HI百分含量的措施是A.
A.降低高温度 B.增大H2浓度 C.加入催化剂 D.降低压强.
| t/min | 2 | 4 | 7 | 9 |
| n(I2)/mol | 0.012 | 0.011 | 0.010 | 0.010 |
(1)2min内,v(H2)=0.002mol/(L•min).
(2)下列能证明该反应已经达到平衡的是BC.
A.v正(H2)=v逆(HI) B.混合气体的颜色不再发生变化
C.混合气体中各组分的物质的量不再发生变化 D.混合气体的密度不再发生变化
(3)该温度下反应的化学平衡常数的数值是1.44.
(4)H2的平衡转化率是37.5%.
(5)温度降低时,该反应的平衡常数增大,则正反应是放热.(填“放热”或“吸热”)反应.
(6)一定可以提高平衡体系中HI百分含量的措施是A.
A.降低高温度 B.增大H2浓度 C.加入催化剂 D.降低压强.
18.科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,生成可进入大气循环的气体,从而实现预期目的.下列判断错误的是( )
| A. | 处理过程中,PH减小 | B. | 废水处理中,亚硝酸盐被还原 | ||
| C. | 废水处理时铝单质转化为AlO2- | D. | 铝粉颗粒大小影响废水处理的速率 |
8.下列几种情况使中和滴定结果偏低的是( )
| A. | 盛待测液的锥形瓶用蒸馏水洗后未用待测液润洗 | |
| B. | 滴定管尖嘴部分在滴定前有气泡 | |
| C. | 滴定管在滴定前未将刻度调在“0.00”,而调在“2.40” | |
| D. | 滴定达终点时,滴定管尖嘴部分有气泡 |
15.在进行中和热的测定中,下列操作错误的是( )
| A. | 为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸) | |
| B. | 为了准确测定反应混合溶液的温度,实验中温度计水银球应一直插入溶液中 | |
| C. | 用0.5 mol•L-1 NaOH溶液分别与0.5mol•L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同 | |
| D. | 为了使反应更完全,可以使酸或碱的浓度适当过量 |
12.在酸性溶液中能大量共存且溶液为无色透明的离子组是( )
| A. | K+、MnO4-、Na+、Cl- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | K+、Na+、NO3-、HCO3- | D. | Fe3+、Na+、CO32-、SO42- |
13.当光束通过稀豆浆时,可产生丁达尔效应,表明稀豆浆属于( )
| A. | 浊液 | B. | 溶液 | C. | 纯净物 | D. | 胶体 |
