题目内容
1.有A、B、C、D、E五种短周期原子序数依次增大,其相关信息如表.| 元素 | 相关信息 |
| A | 原子半径是周期表所有元素中最小的 |
| B | 单质常温下为双原子分子,其氢化物水溶液使酚酞变红 |
| C | 基态原子核外S能级上有电子,且p能级上只有一个轨道排满 |
| D | 同周期中电负性最小 |
| E | E的族序数与周期数之差为4 |
(2)B2分子中σ 键与π键个数之比是1:2;
(3)已知常温下1g A单质在C单质中燃烧生成稳定的液态物质时放出142.9kJ热量,则表示单质A燃烧热的化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
(4)A、B、C三种元素组成一个强酸弱碱盐的化学式为NH4NO3,该物质的晶体类型是离子晶体,其水溶液中各种离子浓度由大到小顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-).
分析 A、B、C、D、E五种短周期原子序数依次增大,A原子半径是周期表所有元素中最小的,则A为H元素;B单质常温下为双原子分子,其氢化物水溶液使酚酞变红,则B为N元素;同周期中D的电负性最小,处于IA族,原子序数大于N,故D为Na;C原子基态原子核外S能级上有电子,且p能级上只有一个轨道排满,原子序数介于N、Na之间,其电子排布为:1s22s22p4,则C为O元素;E的原子序数大于Na,处于第三周期,其族序数与周期数之差为4,故E为Cl,据此解答.
解答 解:A、B、C、D、E五种短周期原子序数依次增大,A原子半径是周期表所有元素中最小的,则A为H元素;B单质常温下为双原子分子,其氢化物水溶液使酚酞变红,则B为N元素;同周期中D的电负性最小,处于IA族,原子序数大于N,故D为Na;C原子基态原子核外S能级上有电子,且p能级上只有一个轨道排满,原子序数介于N、Na之间,其电子排布为:1s22s22p4,则C为O元素;E的原子序数大于Na,处于第三周期,其族序数与周期数之差为4,故E为Cl.
(1)C为O元素,基态原子核外电子排布式为:1s22s22p4,故答案为:1s22s22p4;
(2)N2分子结构式为N≡N,分子中σ 键与π键个数之比是1:2,故答案为:1:2;
(3)常温下1g H2在O2中燃烧生成稳定的液态物质时放出142.9kJ热量,则1mol氢气燃烧放出的热量为142.9kJ×$\frac{1mol×2g/mol}{1g}$=285.8kJ,故表示氢气燃烧热的化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
(4)H、N、O三种元素组成一个强酸弱碱盐的化学式为NH4NO3,该物质属于离子晶体,其水溶液中NH4+离子水解,溶液呈酸性,溶液中各离子浓度由大到小顺序为:c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:NH4NO3;离子晶体;c(NO3-)>c(NH4+)>c(H+)>c(OH-).
点评 本题考查结构性质位置关系综合应用,推断元素是解题关键,注意燃烧热热化学方程式中可燃物为1mol.

| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | HX、HY两种弱酸的酸性:HX<HY | |
| B. | 相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| C. | 结合H+的能力:CO32->Y->X->HCO3- | |
| D. | HX与Na2CO3反应,无气泡产生 |

| A. | 该烃X与等质量的甲烷相比,X燃烧时消耗的氧气更多 | |
| B. | 分子中碳原子的化学环境有2种 | |
| C. | 分子中的氢原子分布在两个互相垂直的直线上 | |
| D. | 分子中既有C-C键也有C=C键 |
| 元素 | 相关信息 |
| X | 元索周期表中核电荷数最小的元素 |
| Y | Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z | Z是大气中含量最多的元素,其某些氧化物为大气中常见的污染物 |
| W | W是地壳中含量最高的金属元素 |
| M | 常见金属,单质呈紫红色 |
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);M的基态原子价电子排布式是3d104s1.
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是3:2,空间构型是直线形.
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途:制硝酸、作制冷剂;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
(5)可用YX4还原ZOx以消除其污染.已知:
YX4 (g)+4ZO2 (g)═4ZO2(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4 (g)+4ZO(g)═2Z2 (g)十YO2 (g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
| A. | 碳、氢、氧的原子个数比为1:2:3 | |
| B. | 碳、氢的原子个数比为1:1 | |
| C. | 该有机物中肯定不含氧元素 | |
| D. | 不能判断该有机物中是否含有氧元素 |
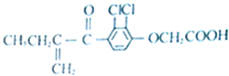
| A. | 分子中有4个碳碳双键 | |
| B. | 该有机物能发生银镜反应 | |
| C. | 既能发生还原反应,又能发生氧化反应 | |
| D. | 1mol该物质最大跟6mol氢气发生反应 |


 (R、R′表示烃基或氢)
(R、R′表示烃基或氢) ,E的结构简式是CH3CHO.
,E的结构简式是CH3CHO.
 .
.