题目内容
6.兴奋剂是体育比赛中禁用的药物,有一种兴奋剂的结构如图,关于它的说法中正确的是( )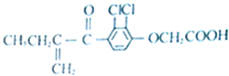
| A. | 分子中有4个碳碳双键 | |
| B. | 该有机物能发生银镜反应 | |
| C. | 既能发生还原反应,又能发生氧化反应 | |
| D. | 1mol该物质最大跟6mol氢气发生反应 |
分析 有机物分子中含碳碳双键、-Cl、C=O及-COOH等,结合烯烃、卤代烃、羧酸的性质来解答.
解答 解:A.分子中只含有1个碳碳双键,苯环不含碳碳双键,故A错误;
B.分子中不含醛基,不能发生银镜反应,故B错误;
C.含有碳碳双键,可与氢气发生加成反应,为还原反应,也可被氧化,故C正确;
D.能与氢气发生加成反应的为碳碳双键,羰基和苯环,则1 mol 该物质最多跟5 mol氢气发生反应,羧基不反应,故D错误.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、酮、苯及卤代烃性质的考查,注意-COOH不能发生加成反应,选项D为解答的难点,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.有A、B、C、D、E五种短周期原子序数依次增大,其相关信息如表.
(1)C的基态原子核外电子排布式1s22s22p4;
(2)B2分子中σ 键与π键个数之比是1:2;
(3)已知常温下1g A单质在C单质中燃烧生成稳定的液态物质时放出142.9kJ热量,则表示单质A燃烧热的化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
(4)A、B、C三种元素组成一个强酸弱碱盐的化学式为NH4NO3,该物质的晶体类型是离子晶体,其水溶液中各种离子浓度由大到小顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-).
| 元素 | 相关信息 |
| A | 原子半径是周期表所有元素中最小的 |
| B | 单质常温下为双原子分子,其氢化物水溶液使酚酞变红 |
| C | 基态原子核外S能级上有电子,且p能级上只有一个轨道排满 |
| D | 同周期中电负性最小 |
| E | E的族序数与周期数之差为4 |
(2)B2分子中σ 键与π键个数之比是1:2;
(3)已知常温下1g A单质在C单质中燃烧生成稳定的液态物质时放出142.9kJ热量,则表示单质A燃烧热的化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
(4)A、B、C三种元素组成一个强酸弱碱盐的化学式为NH4NO3,该物质的晶体类型是离子晶体,其水溶液中各种离子浓度由大到小顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-).
1.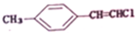 分子中共平面的原子最多有( )
分子中共平面的原子最多有( )
 分子中共平面的原子最多有( )
分子中共平面的原子最多有( )| A. | 15个 | B. | 16个 | C. | 17个 | D. | 19个 |
11. 实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,反应原理为:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$HBr+NaHSO4,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.实验结束发现试管a中的物质分为三层.对该实验的分析不正确的是( )
实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,反应原理为:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$HBr+NaHSO4,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.实验结束发现试管a中的物质分为三层.对该实验的分析不正确的是( )
 实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,反应原理为:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$HBr+NaHSO4,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.实验结束发现试管a中的物质分为三层.对该实验的分析不正确的是( )
实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,反应原理为:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$HBr+NaHSO4,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.实验结束发现试管a中的物质分为三层.对该实验的分析不正确的是( )| A. | 产物在a中第一层 | |
| B. | a中有产物和水,还含HBr、Br2、CH3CH2OH等 | |
| C. | 反应过程中浓硫酸显示酸性、强氧化性、脱水性、难挥发性等性质 | |
| D. | 烧瓶中除发生取代反应可能发生消去反应、氧化还原反应等 |
18.下列说法中错误的是( )
| A. | 燃料的燃烧反应都是放热反应 | |
| B. | -定量的燃料完全燃烧放出的热量比不完全燃烧放出的热量大 | |
| C. | 放热反应的逆反应一定是吸热反应 | |
| D. | 吸热反应没有应用价值 |
15.下列元素中,原子半径最小的是( )
| A. | Na | B. | K | C. | Cl | D. | F |
 .
.