题目内容
15.科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型,如图.下列说法中不正确的是( )
| A. | 该烃X与等质量的甲烷相比,X燃烧时消耗的氧气更多 | |
| B. | 分子中碳原子的化学环境有2种 | |
| C. | 分子中的氢原子分布在两个互相垂直的直线上 | |
| D. | 分子中既有C-C键也有C=C键 |
分析 A.由结构简式可知分子式为C5H4,根据燃烧方程式:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,等质量的X和甲烷分别充分燃烧,甲烷消耗的氧气多;
B.经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,所以分子中只含有1种H原子,分子结构对称,碳原子的化学环境有2种;
C.根据C能形成4个共价键,两个互相垂直的碳上有氢原子;
D.X分子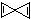 中既有碳碳单键,又有碳碳双键.
中既有碳碳单键,又有碳碳双键.
解答 解:A.X的分子式为C5H4,根据燃烧方程式:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,充分燃烧等质量的X和甲烷,$\frac{m}{16}$×2>$\frac{m}{64}$×6,则甲烷消耗氧气多,故A错误;
B.分子结构对称,只含有1种H原子,分子中碳原子的化学环境有2种,故B正确;
C.根据C能形成4个共价键,由图可知X分子结构简式为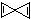 ,分子中的氢原子分布在两个互相垂直的直线上,故C正确;
,分子中的氢原子分布在两个互相垂直的直线上,故C正确;
D.根据C能形成4个共价键,由图可知X分子结构简式为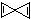 ,既有碳碳单键,又有碳碳双键,故D正确;
,既有碳碳单键,又有碳碳双键,故D正确;
故选A.
点评 本题是一道信息给予题,解答本题的关键是要充分理解图中信息方面的知识,题目难度不大.

练习册系列答案
相关题目
3.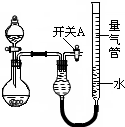 某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
请回答下列问题:
(1)Cu与稀HNO3反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度.你认为是否可行?不可行(可行、不可行),请简述原因因为NO会与装置中空气反应后溶于水,使测得的NO气体体积不准.
(3)实验②、③中,量气管中的液体最好分别是A、C.(只选一种)
A.CCl4 B.H2OC.饱和NaHCO3溶 D.液饱和Na2CO3溶液
(4)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②使量气管两端液面相,③视线与凹液面最低处相平.
(5)实验④用于测定合金中铝的质量分数,获得以下数据(气体体积均已换算成标准状况)
根据上述合理数据计算镁铝合金中铝的质量分数27%.
 某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
某同学设计如图所示装置分别进行探究实验(夹持装置已略去)| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、稀HNO3 | H2O | |
| ② | NaOH固体、浓氨水 | NH3 | |
| ③ | Na2CO3固体、稀H2SO4 | CO2 | |
| ④ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
(1)Cu与稀HNO3反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度.你认为是否可行?不可行(可行、不可行),请简述原因因为NO会与装置中空气反应后溶于水,使测得的NO气体体积不准.
(3)实验②、③中,量气管中的液体最好分别是A、C.(只选一种)
A.CCl4 B.H2OC.饱和NaHCO3溶 D.液饱和Na2CO3溶液
(4)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②使量气管两端液面相,③视线与凹液面最低处相平.
(5)实验④用于测定合金中铝的质量分数,获得以下数据(气体体积均已换算成标准状况)
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 1.0g | 10.0mL | 347.5mL |
| 2 | 1.0g | 10.0mL | 335.0mL |
| 3 | 1.0g | 10.0mL | 344.5mL |
20.某有机物的结构简式如图所示,下列有关该有机物的说法正确的是( )
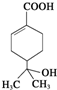

| A. | 分子中含有两种官能团 | |
| B. | 可使溴水和酸性高锰酸钾溶液褪色,且原理相同 | |
| C. | 能发生加成、取代、氧化、消去等反应 | |
| D. | 与钠和氢氧化钠溶液都能发生反应,且得到的产物相同 |
6.下列说法正确的是( )
| A. | 该  有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 等质量的某烷烃a和某烯烃b,两者完全烧烧后产生的CO2的量有可能a>b | |
| C. |  该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 1mol该有机物 在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 12mol 在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 12mol |
1.有A、B、C、D、E五种短周期原子序数依次增大,其相关信息如表.
(1)C的基态原子核外电子排布式1s22s22p4;
(2)B2分子中σ 键与π键个数之比是1:2;
(3)已知常温下1g A单质在C单质中燃烧生成稳定的液态物质时放出142.9kJ热量,则表示单质A燃烧热的化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
(4)A、B、C三种元素组成一个强酸弱碱盐的化学式为NH4NO3,该物质的晶体类型是离子晶体,其水溶液中各种离子浓度由大到小顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-).
| 元素 | 相关信息 |
| A | 原子半径是周期表所有元素中最小的 |
| B | 单质常温下为双原子分子,其氢化物水溶液使酚酞变红 |
| C | 基态原子核外S能级上有电子,且p能级上只有一个轨道排满 |
| D | 同周期中电负性最小 |
| E | E的族序数与周期数之差为4 |
(2)B2分子中σ 键与π键个数之比是1:2;
(3)已知常温下1g A单质在C单质中燃烧生成稳定的液态物质时放出142.9kJ热量,则表示单质A燃烧热的化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
(4)A、B、C三种元素组成一个强酸弱碱盐的化学式为NH4NO3,该物质的晶体类型是离子晶体,其水溶液中各种离子浓度由大到小顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-).
 2,3,4-三甲基-3-乙基己烷
2,3,4-三甲基-3-乙基己烷 4-甲基-2-戊烯
4-甲基-2-戊烯 乙苯
乙苯


 .
.


 ;⑤的反应条件是NaOH的醇溶液、加热;⑧的反应类型是加聚反应.
;⑤的反应条件是NaOH的醇溶液、加热;⑧的反应类型是加聚反应. .
. .
. )合成2-甲基-3-甲酸甲酯吲哚的反应方程式
)合成2-甲基-3-甲酸甲酯吲哚的反应方程式 .
.