题目内容
用Cr3+掺杂的氮化铝是理想的LED用荧光粉基质材料,氮化铝(其晶胞如图所示)可由氯化铝与氨经气相反应制得。
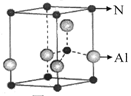
(1)Cr3+基态的核外电子排布式可表示为 。
(2)氮化铝的化学式为 。
(3)氯化铝易升华,其双聚物Al2Cl6结构如图所示。在Al2Cl6中存在的化学键有 (填字母)。

a.离子键 b.共价键 c.配位键 d.金属键
(4)一定条件下用Al2O3和CCl4反应制备AlCl3的反应为:Al2O3+3CCl4=2AlCl3+3COCl2。其中,COCl2分子的空间构型为 。一种与CCl4互为等电子体的离子的化学式为 。
(5)AlCl3在下述反应中作催化剂。分子③中碳原子的杂化类型为 。


(1)Cr3+基态的核外电子排布式可表示为 。
(2)氮化铝的化学式为 。
(3)氯化铝易升华,其双聚物Al2Cl6结构如图所示。在Al2Cl6中存在的化学键有 (填字母)。

a.离子键 b.共价键 c.配位键 d.金属键
(4)一定条件下用Al2O3和CCl4反应制备AlCl3的反应为:Al2O3+3CCl4=2AlCl3+3COCl2。其中,COCl2分子的空间构型为 。一种与CCl4互为等电子体的离子的化学式为 。
(5)AlCl3在下述反应中作催化剂。分子③中碳原子的杂化类型为 。

(1)1s22s22p63s23p63d3或[Ar]3d3(2分)
(2)AlN(2分)
(3)bc(2分)
(4)平面三角形(2分) SO42-或PO43-或ClO4-或SiO44-或PCl4+(2分)
(5)sp2和sp3(2分)
(2)AlN(2分)
(3)bc(2分)
(4)平面三角形(2分) SO42-或PO43-或ClO4-或SiO44-或PCl4+(2分)
(5)sp2和sp3(2分)
试题分析:(2)氮原子在晶胞的顶点和内部,共有8×1/8+1=2;铝原子在晶胞的棱上和内部,共有4×1/4+1=2;化学式为AlN;(3)氯最外层有7个电子已形成1个共用电子对达到8电子的稳定结构,中间的氯与铝原子形成了2个共价键,故其中之一为配位键,由氯原子提供孤电子对,铝原子提供空轨道形成配位键;(4)COCl2分子中碳原子的价电子对数为(4+2)÷2=3,为sp2杂化,又有3个配位原子故为平面三角形;等电子体(原子数同,价电子数同)有SO42-或PO43-或ClO4-或SiO44-或PCl4+;(5)分子③中碳原子中形成双键的为sp2杂化,全形成单键的为sp3杂化。

练习册系列答案
相关题目
 ,下列有关说法正确的是________(填选项字母)。
,下列有关说法正确的是________(填选项字母)。
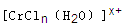 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应: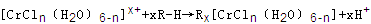
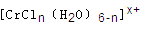 的溶液,与R-H完全交换后,中和生成的需浓度为
的溶液,与R-H完全交换后,中和生成的需浓度为 键有________mol。
键有________mol。


 ,其余各能层电子全充满。
,其余各能层电子全充满。


 的空间构型为 (用文字描述)。
的空间构型为 (用文字描述)。