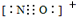题目内容
A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大。已知A的一种核素的质量数等于其质子数;E原子最外层电子数为其电子层数的两倍,C、E是同主族元素;B的第一电离能大于C的第一电离能;D离子在同周期离子中半径最小。G的最外层电子排布图为 ,其余各能层电子全充满。
,其余各能层电子全充满。
(1)画出B原子的结构示意图____,G+离子的电子排布式为_____。
(2)C与E组成的一种化合物具有漂白性,该化合物分子中中心原子的VSEPR构型为 。
(3)D单质具有良好导热性的原因是____。
(4)E、F的最高价氧化物对应的水化物的酸性强弱比较(填写化学式):_____>_____。
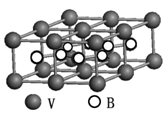
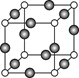
(5)G单质的晶胞结构如图所示,则一个晶胞中G的原子个数为_____。

(6)A与B形成的10电子阳离子在重水中的水解离子方程式为____。
 ,其余各能层电子全充满。
,其余各能层电子全充满。(1)画出B原子的结构示意图____,G+离子的电子排布式为_____。
(2)C与E组成的一种化合物具有漂白性,该化合物分子中中心原子的VSEPR构型为 。
(3)D单质具有良好导热性的原因是____。
(4)E、F的最高价氧化物对应的水化物的酸性强弱比较(填写化学式):_____>_____。
(5)G单质的晶胞结构如图所示,则一个晶胞中G的原子个数为_____。

(6)A与B形成的10电子阳离子在重水中的水解离子方程式为____。
(1)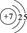 ;1s22s22p63s23p63d10;(2)平面三角形;
;1s22s22p63s23p63d10;(2)平面三角形;
(3)在热的作用下,自由电子与金属铝离子频繁碰撞,形成热的传导;
(4)HClO4>H2SO4 (5)4; (6)NH4++D2O NH3·HDO+D+。
NH3·HDO+D+。
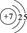 ;1s22s22p63s23p63d10;(2)平面三角形;
;1s22s22p63s23p63d10;(2)平面三角形; (3)在热的作用下,自由电子与金属铝离子频繁碰撞,形成热的传导;
(4)HClO4>H2SO4 (5)4; (6)NH4++D2O
 NH3·HDO+D+。
NH3·HDO+D+。试题分析:由题目提供的信息可知A为H;B为N;C为O;D为Al ; E 为S;F为Cl;G为Cu。(1)N原子的结构示意图
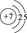 。Cu+离子的电子排布式为1s22s22p63s23p63d10;(2)SO2具有漂白性,该化合物分子中中心原子的VSEPR构型为平面三角形。(3)金属Al是由Al3+和自由电子构成的。当给某金属加热时,该区域的金属阳离子和自由电子的能量都增大,自由电子的质量小,惯性小,运动速度快,当其运动碰撞其它金属阳离子时,就把能量传递给该区域的金属,自由电子与金属铝离子频繁碰撞,形成热的传导;从而使整个金属的温度趋于一致,因此金属具有良好导热性。(4)元素的非金属性Cl>S。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。所以E、F的最高价氧化物对应的水化物的酸性强弱顺序是HClO4>H2SO4;(5)一个晶胞中G的原子个数为8×1/8+6×1/2="4." (6)A与B形成的10电子阳离子为NH4+,在重水(D2O)中的水解离子方程式为NH4++D2O
。Cu+离子的电子排布式为1s22s22p63s23p63d10;(2)SO2具有漂白性,该化合物分子中中心原子的VSEPR构型为平面三角形。(3)金属Al是由Al3+和自由电子构成的。当给某金属加热时,该区域的金属阳离子和自由电子的能量都增大,自由电子的质量小,惯性小,运动速度快,当其运动碰撞其它金属阳离子时,就把能量传递给该区域的金属,自由电子与金属铝离子频繁碰撞,形成热的传导;从而使整个金属的温度趋于一致,因此金属具有良好导热性。(4)元素的非金属性Cl>S。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。所以E、F的最高价氧化物对应的水化物的酸性强弱顺序是HClO4>H2SO4;(5)一个晶胞中G的原子个数为8×1/8+6×1/2="4." (6)A与B形成的10电子阳离子为NH4+,在重水(D2O)中的水解离子方程式为NH4++D2O NH3·HDO+D+;
NH3·HDO+D+;
练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目