题目内容
A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增。已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题。
(1)画出C元素的原子结构示意图 。
(2)在1mol DC2中,有 mol D—C键。
(3)在化合物BC2的晶体中,每个BC2分子周围与它距离最近的BC2分子有 个。
(4)原子序数介于B、C之间的元素X和B、C都可与A形成10e-的化合物。则X、B、C的第一电离能顺序是 (填元素符号),三种10e-的化合物中沸点最低的 。
(5)已知高温下C和E元素形成的晶体呈立方体结构,晶体中元素C的化合价部分为0价,部分为-2价。如下图所示为C和E元素形成的晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是 。

A.该晶体化学式为EC2(KO2),每个晶胞含有个4个E+和4个C2-
B.晶体中每个E+周围有8个C2-,每个C2-周围有8个E+
C.晶体中与每个E+距离最近的E+有8个
D.晶体中,0价C与-2价C的数目比为3:1
E.C2-与N2互为等电子体
(1)画出C元素的原子结构示意图 。
(2)在1mol DC2中,有 mol D—C键。
(3)在化合物BC2的晶体中,每个BC2分子周围与它距离最近的BC2分子有 个。
(4)原子序数介于B、C之间的元素X和B、C都可与A形成10e-的化合物。则X、B、C的第一电离能顺序是 (填元素符号),三种10e-的化合物中沸点最低的 。
(5)已知高温下C和E元素形成的晶体呈立方体结构,晶体中元素C的化合价部分为0价,部分为-2价。如下图所示为C和E元素形成的晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是 。

A.该晶体化学式为EC2(KO2),每个晶胞含有个4个E+和4个C2-
B.晶体中每个E+周围有8个C2-,每个C2-周围有8个E+
C.晶体中与每个E+距离最近的E+有8个
D.晶体中,0价C与-2价C的数目比为3:1
E.C2-与N2互为等电子体
(1)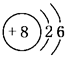 (2)4 (3)12(4) C<O<N (N>O>C) CH4 (5)AD
(2)4 (3)12(4) C<O<N (N>O>C) CH4 (5)AD
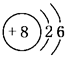 (2)4 (3)12(4) C<O<N (N>O>C) CH4 (5)AD
(2)4 (3)12(4) C<O<N (N>O>C) CH4 (5)AD 试题分析:B、D两种元素原子的最外层电子数是最内层电子数的两倍,则B的核外电子排布是2、4,是C元素;D的核外电子排布是2、8、4,是Si元素;C原子序数大于6,而且C元素原子的最外层电子数等于B元素原子的核外电子数,则C的核外电子排布是2、6,是O元素;E的价电子数为1原子序数大于Si。则E为K元素。(1)O元素的原子结构示意图为
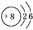 。(2)SiO2是原子晶体,每个Si原子与4个O原子形成4个Si—O共价键。所以在1moSiO2中,有4mol Si—O键。(3)CO2在固态时是分子晶体,其晶体类型为立方面心结构。所以在每个晶胞中与它距离最近的CO2分子的个数为3个,通过一个CO2可以形成8个晶胞,而且每个CO2都重复了2次,所以在化合物CO2的晶体中,每个CO2分子周围与它距离最近的CO2分子有(8×3)÷2=12.(4)由于元素X原子序数介于B、C之间,所以X是N元素。它与C、O都可与与A形成的10e-的化合物。由于A的原子序数小于6 ,则A为H元素。一般情况下,原子序数越大,元素的电负性越大,元素的第一电离能就越大。但是由于N原子核外的电子排布处于半充满的稳定状态,所以去第一电离能比O还要大些。因此C、N、O三元素的第一电离能大小关系为:N>O>C或C<O<N。三种元素形成的10e-的化合物是CH4、NH3、H2O。由于N、O电负性大,原子半径小,所以在NH3、H2O的分子之间除了存在分子间作用力外还存在氢键,而CH4的分子之间只存在分子间作用力。因此甲烷的沸点最低。(5)A.由晶胞结构示意图可知:在该晶胞中含有K+:8×1/8+6×1/2=4;O2-:1+12×1/4=4.所以K+:O2-=1:1;在一个晶胞中含有KO2。正确。B.晶体中每个E+周围有6个O2-,每个C2-周围有6个K+.错误。C.晶体中与每个E+距离最近的E+有(8×3)÷2=12个.错误。D.在晶体中,假设0价O为x,-2价O为y。则x+y=2;0+(-2)y=-1.解得x=3/2;y=1/2。所以0价O与-2价O的数目比为3:1。正确。E.O2-电子数为17,与N2电子数为14.所以二者不能互为等电子体。错误。2、CO2、KO2的晶体结构及晶胞中含有的微粒数目及第一电离能的大小比较的知识。
。(2)SiO2是原子晶体,每个Si原子与4个O原子形成4个Si—O共价键。所以在1moSiO2中,有4mol Si—O键。(3)CO2在固态时是分子晶体,其晶体类型为立方面心结构。所以在每个晶胞中与它距离最近的CO2分子的个数为3个,通过一个CO2可以形成8个晶胞,而且每个CO2都重复了2次,所以在化合物CO2的晶体中,每个CO2分子周围与它距离最近的CO2分子有(8×3)÷2=12.(4)由于元素X原子序数介于B、C之间,所以X是N元素。它与C、O都可与与A形成的10e-的化合物。由于A的原子序数小于6 ,则A为H元素。一般情况下,原子序数越大,元素的电负性越大,元素的第一电离能就越大。但是由于N原子核外的电子排布处于半充满的稳定状态,所以去第一电离能比O还要大些。因此C、N、O三元素的第一电离能大小关系为:N>O>C或C<O<N。三种元素形成的10e-的化合物是CH4、NH3、H2O。由于N、O电负性大,原子半径小,所以在NH3、H2O的分子之间除了存在分子间作用力外还存在氢键,而CH4的分子之间只存在分子间作用力。因此甲烷的沸点最低。(5)A.由晶胞结构示意图可知:在该晶胞中含有K+:8×1/8+6×1/2=4;O2-:1+12×1/4=4.所以K+:O2-=1:1;在一个晶胞中含有KO2。正确。B.晶体中每个E+周围有6个O2-,每个C2-周围有6个K+.错误。C.晶体中与每个E+距离最近的E+有(8×3)÷2=12个.错误。D.在晶体中,假设0价O为x,-2价O为y。则x+y=2;0+(-2)y=-1.解得x=3/2;y=1/2。所以0价O与-2价O的数目比为3:1。正确。E.O2-电子数为17,与N2电子数为14.所以二者不能互为等电子体。错误。2、CO2、KO2的晶体结构及晶胞中含有的微粒数目及第一电离能的大小比较的知识。
练习册系列答案
相关题目





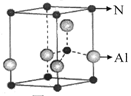


 键 mol。
键 mol。