题目内容
物质的结构是决定物质性质的重要因素。请回答下列问题:
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_______________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的 键有________mol。
键有________mol。
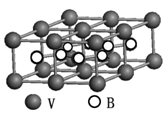
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金化学式为 ;

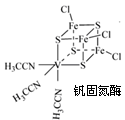
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟Ni2+反应可生成鲜红色沉淀,其结构如图2所示:

①该结构中,碳碳之间共价键是σ键,碳氮之间共价键是 ,氮镍之间形成化学键是 ;
②该结构中,氧氢之间除共价键外还可存在 ;
③该结构中,碳原子杂化轨道有
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_______________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的
 键有________mol。
键有________mol。(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金化学式为 ;

(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟Ni2+反应可生成鲜红色沉淀,其结构如图2所示:

①该结构中,碳碳之间共价键是σ键,碳氮之间共价键是 ,氮镍之间形成化学键是 ;
②该结构中,氧氢之间除共价键外还可存在 ;
③该结构中,碳原子杂化轨道有
(1)1s22s22p63s23p63d84s2或[Ar]3d84s2 C
(2) > 3
(3)3
(4)LaNi5
(5)①σ键,π键 配位键 ②氢键 ③sp2,sp3
(2) > 3
(3)3
(4)LaNi5
(5)①σ键,π键 配位键 ②氢键 ③sp2,sp3
(1)Ni是28号,其核外电子排布式是1s22s22p63s23p63d84s2或[Ar]3d84s2,其3d轨道中有2个未成对电子,与碳和氧相同,但电负性碳比氧小,所以本小问的答案是C。
(2)离子半径越小,离子键越强,所以NiO的熔点比FeO的熔点要高。由与NiO晶胞结构与NaCl相似,所以Ni2+的配位数是6;
(3)氮气的结构式为N≡N,其中分子结构中含有一个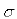 有二个π键,所以生成1.5molN2分子中含有3molπ。
有二个π键,所以生成1.5molN2分子中含有3molπ。
(4)晶胞中La原子数=8×1/8=1,Ni原子数=1+8×1/2=5,即化学式为LaNi5
(5)双键是由一个σ键和一个π键构成;镍原子有空轨道,氮原子有孤电子对,因此二者形成配位键;丁二酮肟中碳原子既有单键又有双键,因此杂化类型是sp2和sp3杂化。
(2)离子半径越小,离子键越强,所以NiO的熔点比FeO的熔点要高。由与NiO晶胞结构与NaCl相似,所以Ni2+的配位数是6;
(3)氮气的结构式为N≡N,其中分子结构中含有一个
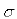 有二个π键,所以生成1.5molN2分子中含有3molπ。
有二个π键,所以生成1.5molN2分子中含有3molπ。(4)晶胞中La原子数=8×1/8=1,Ni原子数=1+8×1/2=5,即化学式为LaNi5
(5)双键是由一个σ键和一个π键构成;镍原子有空轨道,氮原子有孤电子对,因此二者形成配位键;丁二酮肟中碳原子既有单键又有双键,因此杂化类型是sp2和sp3杂化。

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目









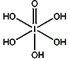 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4 (填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4 (填“>”、 “<”或“=”)
