题目内容
18.向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成.经查资料得知:Ag++2NH3•H2O?[Ag(NH3)2]++2H2O.下列分析不正确的是( )| A. | 浊液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+CI-(aq) | |
| B. | 实验可以证明NH3结合Ag+能力比Cl-强 | |
| C. | 实验表明实验室可用氨水洗涤银镜反应后的试管 | |
| D. | 由资料信息可推知:加浓硝酸后生成的沉淀为AgCl |
分析 A.难溶电解质存在溶解平衡;
B.Ag+与氨气分子结合生成二氨合银离子,导致银离子浓度减小,促使AgCl (s)?Ag+(aq)+Cl-(aq)正向移动;
C.银镜反应后的试管壁上是银单质,其不能和氨水反应;
D.浓硝酸能够中和一水合氨,使反应Ag++2NH3•H2O?Ag(NH3)2++2H2O逆向移动,二氨合银离子生成银离子,与溶液中的氯离子结合.
解答 解:A.AgCl为难溶电解质,在浊液中存在沉淀溶解平衡,故A正确;
B.Ag+与氨气分子结合生成二氨合银离子,导致银离子浓度减小,促使AgCl (s)?Ag+(aq)+Cl-(aq)正向移动,说明NH3结合Ag+能力比Cl-强,故B正确;
C.银镜反应后的试管壁上是银单质,银离子能够与氨水反应,银单质不能,故C错误;
D.浓硝酸能够中和一水合氨,使反应Ag++2NH3•H2O?Ag(NH3)2++2H2O逆向移动,二氨合银离子生成银离子,与溶液中的氯离子结合生成沉淀,所以加浓硝酸后生成的沉淀为AgCl,故D正确;
故选C.
点评 本题考查了沉淀的溶解平衡的移动,为高频考点,侧重于学生的分析能力的考查,注意银离子能够与氨水反应,银单质不能,题目难度中等.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
8.下列性质中不属于烷烃具有性质的是( )
| A. | 燃烧产物只有CO2和H2O | B. | 与卤素单质发生取代反应 | ||
| C. | 都溶于水 | D. | 通常不与强酸、强碱、强氧化剂反应 |
9.下列装置不能完成相应实验的是( )
| A. | 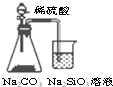 装置可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 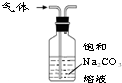 装置可除去CO2中少量的SO2杂质 | |
| C. | 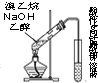 装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| D. | 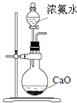 装置可用于实验室制备氨气 |
6.下列事实与胶体性质无关的是(填字母序号)( )
| A. | 土壤中离子的吸附和交换过程,有保肥作用 | |
| B. | 由肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 | |
| C. | 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染 | |
| D. | 臭氧、Cl2均可用于水的消毒净化 |
13.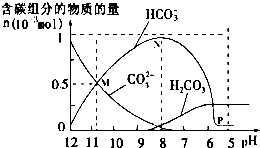 25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
 25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )| A. | HCl溶液滴加一半时,溶液pH>7 | |
| B. | 当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol•L-1 | |
| C. | 0.1 mol•L-1Na2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) | |
| D. | 在M点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
3.下列操作和现象与结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向盐酸酸化的Ba(NO3)2溶液中通入SO2 | 有白色沉淀生成 | BaSO3难溶于酸 |
| B | 向等浓度的KCl、Kl混合液中滴加AgNO3溶液 | 先出现白色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 溴乙烷与NaOH水溶液共热后,加HNO3酸化,滴加AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷含溴元素 |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
10.下列有关仪器的使用方法或实验操作正确的是( )
| A. | 用陶瓷坩埚熔化氢氧化钠固体 | |
| B. | 用碱式滴定管准确量取15.00mLKMnO4溶液 | |
| C. | 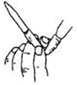 用如图所示操作排除碱式滴定管中的气泡 | |
| D. | 用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 |
7.非金属元素R位于第三周期,其原子的最外层有n个电子,则以下叙述错误的是( )
| A. | R原子的电子数为10+n | B. | R能形成Rn-离子 | ||
| C. | R的最高氧化物为R2On或ROn/2 | D. | R的气态氢化物的化学式是H8-nR |
 2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录.该化合晶体结构中的晶胞如图所示.镁原子间形成正六棱柱,六个硼原子位于棱柱内.
2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录.该化合晶体结构中的晶胞如图所示.镁原子间形成正六棱柱,六个硼原子位于棱柱内. .
.