题目内容
19.在450℃、1.50X107Pa条件下,Na2O与O2反应生成Na02,Na02可用于应急呼吸面罩:4NaO2+2C02→2Na2C03+302,4NaO2+2H20(g)+4CO2→4NaHCO3+302
某呼吸面罩中放置了5OOg NaO2,吸收CO2和H20(g),每产生18.48L(换算为标准状况)O2时,固体的质量就增加13.30g.计算生成的Na2CO3和NaHCO3物质的量之比3:5.
分析 设碳酸钠和碳酸氢钠的物质的量分别为xmol和ymol,根据方程式4NaO2+2C02═2Na2C03+302,4NaO2+2H20(g)+4CO2═4NaHCO3+302,结合每产生18.48L(换算为标准状况)O2时,固体的质量就增加13.30g,列方程组求解.
解答 解:设碳酸钠和碳酸氢钠的物质的量分别为xmol和ymol,
4NaO2+2C02═2Na2C03+302 ,固体质量△m
4 2 3 8g
2x x 1.5x 4xg
由方程式:
4NaO2+2H20(g)+4CO2═4NaHCO3+302,固体质量△m
4 4 3 116
y y 0.75y 29yg
所以$\left\{\begin{array}{l}{1.5x+0.75y=\frac{18.48}{22.4}}\\{4x+29y=13.3}\end{array}\right.$;解之得$\left\{\begin{array}{l}{x=0.3}\\{y=0.5}\end{array}\right.$,Na2CO3和NaHCO3物质的量之比:0.3:0.5=3:5,
故答案为:3:5.
点评 本题考查学生根据化学方程式进行计算,学生要充分利用两组数据结合固体的质量的变化列方程组解题这是关键,有一定的难度.

练习册系列答案
相关题目
9.下列装置不能完成相应实验的是( )
| A. |  装置可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. |  装置可除去CO2中少量的SO2杂质 | |
| C. | 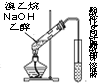 装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| D. | 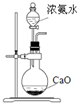 装置可用于实验室制备氨气 |
10.下列有关仪器的使用方法或实验操作正确的是( )
| A. | 用陶瓷坩埚熔化氢氧化钠固体 | |
| B. | 用碱式滴定管准确量取15.00mLKMnO4溶液 | |
| C. |  用如图所示操作排除碱式滴定管中的气泡 | |
| D. | 用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 |
7.非金属元素R位于第三周期,其原子的最外层有n个电子,则以下叙述错误的是( )
| A. | R原子的电子数为10+n | B. | R能形成Rn-离子 | ||
| C. | R的最高氧化物为R2On或ROn/2 | D. | R的气态氢化物的化学式是H8-nR |
4.下列事实能用元素周期律解释的是( )
| A. | 沸点:H2O>H2Se>H2S | B. | 酸性:H2SO4>H2CO3>HClO | ||
| C. | 硬度:I2>Br2>Cl2 | D. | 碱性:KOH>NaOH>Al(OH)3 |
11.如表各选项中对应的实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现 象 | 结 论 |
| A | 在试管中滴入适量C2H5X与NaOH溶液,振荡、加热、静置分层后,取水层加稀硝酸酸化,再滴加数滴AgNO3溶液 | 淡黄色沉淀 | 证明卤代烃中含有溴元素 |
| B | 将蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口 | 有大量白烟 | 该无机酸一定为盐酸 |
| C | 在大试管中依次加入适量丁醇、过量乙酸、几滴浓硫酸,混合后塞上带长导管的试管塞,放在石棉网上方空气中加热至120℃左右 | 反应液沸腾,冷却静置,上层油状透明液体有水果香味 | 该油状液体为乙酸丁酯 |
| D | 在简易启普发生器中向石灰石中加入浓醋酸,将产生的气体直接通入苯酚钠溶液中 | 苯酚钠溶液产生浑浊 | 酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
5.某实验小组的同学为了探究CuSO4溶液与Na2CO3溶液的反应原理并验证产物,进行如下实验.
实验I:将CuSO4溶液与Na2CO3溶液混合,一定温度下充分反应至不产生气泡为止,
过滤、冷水洗涤、低温干燥,得到蓝绿色固体.该小组同学猜想此固体为xCuCO3•yCu(OH)2.
(1)为了验证猜想,先进行定性实验.
(2)为进一步确定蓝绿色固体的组成,使用如下装置再进行定量实验.

实验Ⅲ:称取5.190g样品,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置C和D中.
①装置C中盛放的试剂是无水氯化钙,装置E的作用是防止空气中的二氧化碳和水蒸气进入装置D影响测定结果,反应结束时要通入适量的空气,其作用是使分解产生的水蒸气、二氧化碳气体全部进入装置C、D中吸收.
②实验结束后,测得装置C增重0.270g,装置D增重1.320g.则该蓝绿色固体的化学式为2CuCO3•Cu(OH)2.
(3)若x=y=1,写出CuSO4溶液与Na2CO3溶液混合时反应的化学方程式2CuSO4+2Na2CO3+H2O=CuCO3•Cu(OH)2↓+CO2↑+Na2SO4.
(4)已知20℃时溶解度数据:S[Ca(OH)2]=0.16g,S[Ba(OH)2]=3.89g.有同学据此提出可将装置D中的澄清石灰水换成等体积的饱和Ba(OH)2溶液,其可能的依据之一是Ba(OH)2溶解度大于Ca(OH)2,相同体积的饱和氢氧化钡溶液吸收二氧化碳多.
(5)有同学为了降低实验误差,提出如下建议,其中合理的是(填字母序号).
A.加热装置B前,先通空气一段时间后再称量C、D的初始质量
B.将D换为盛有碱石灰的U形管
C.将C、D颠倒并省去E装置.
实验I:将CuSO4溶液与Na2CO3溶液混合,一定温度下充分反应至不产生气泡为止,
过滤、冷水洗涤、低温干燥,得到蓝绿色固体.该小组同学猜想此固体为xCuCO3•yCu(OH)2.
(1)为了验证猜想,先进行定性实验.
| 实验序号 | 实验步骤 | 实验现象 | 结论 |
| 实验Ⅱ | 取适量蓝绿色固体,加入足量稀硫酸 | 固体溶解,生成蓝色溶液, 产生无色气体 | 蓝绿色固体中含有C${{O}_{3}}^{2-}$ |

实验Ⅲ:称取5.190g样品,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置C和D中.
①装置C中盛放的试剂是无水氯化钙,装置E的作用是防止空气中的二氧化碳和水蒸气进入装置D影响测定结果,反应结束时要通入适量的空气,其作用是使分解产生的水蒸气、二氧化碳气体全部进入装置C、D中吸收.
②实验结束后,测得装置C增重0.270g,装置D增重1.320g.则该蓝绿色固体的化学式为2CuCO3•Cu(OH)2.
(3)若x=y=1,写出CuSO4溶液与Na2CO3溶液混合时反应的化学方程式2CuSO4+2Na2CO3+H2O=CuCO3•Cu(OH)2↓+CO2↑+Na2SO4.
(4)已知20℃时溶解度数据:S[Ca(OH)2]=0.16g,S[Ba(OH)2]=3.89g.有同学据此提出可将装置D中的澄清石灰水换成等体积的饱和Ba(OH)2溶液,其可能的依据之一是Ba(OH)2溶解度大于Ca(OH)2,相同体积的饱和氢氧化钡溶液吸收二氧化碳多.
(5)有同学为了降低实验误差,提出如下建议,其中合理的是(填字母序号).
A.加热装置B前,先通空气一段时间后再称量C、D的初始质量
B.将D换为盛有碱石灰的U形管
C.将C、D颠倒并省去E装置.
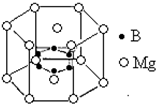 2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录.该化合晶体结构中的晶胞如图所示.镁原子间形成正六棱柱,六个硼原子位于棱柱内.
2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录.该化合晶体结构中的晶胞如图所示.镁原子间形成正六棱柱,六个硼原子位于棱柱内. .
.