题目内容
【题目】铁是用途最广的金属材料之一,但生铁易生锈。请讨论电化学实验中有关铁的性质。
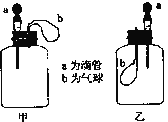
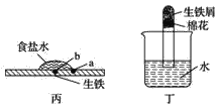
(1)①某原电池装置如图所示,右侧烧杯中的电极反应式为__,左侧烧杯中的c(Cl-)__(填“增大”、“减小”或“不变”)。
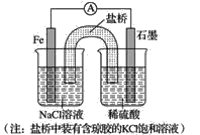
②已知如图甲、乙两池的总反应式均为Fe+H2SO4=FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料_____(填“Fe”或“C”)。
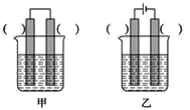
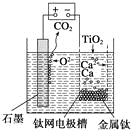
(2)装置丙中,易生锈的是__(填“a”或“b”)点。装置丁中可观察到的实验现象是__。
【答案】2H++2e-=H2↑ 增大 甲池中:左—Fe,右—C;乙池中:左—Fe,右—C a 铁屑表面生成红棕色锈斑,试管内液面上升
【解析】
(1)①图为原电池反应,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生2H++2e-=H2;原电池中阴离子向负极移动;
②Fe和H2SO4之间的反应结合电解池和原电池的原理分析回答;
(2)装置丙中,根据易生锈的是构成原电池作负极的分析,根据吸氧腐蚀消耗了空气中的氧气,使试管内压强降低,则大气压使试管中液面会上升.
(1)①电池反应中Fe作负极,石墨棒作正极,右侧电极反应式为2H++2e-=H2↑。由于平衡电荷的需要,盐桥中的Cl-向负极迁移,故NaCl溶液中c(Cl-)增大。
故答案为:2H++2e-=H2↑;增大;
②装置乙是电解装置,阴极(右侧)产生H2,同时根据总反应式可知Fe只能作阳极(左侧)。由已知条件知,在装置甲中,Fe作原电池的负极,在左侧,C作原电池的正极,在右侧。
故答案为:甲池中:左—Fe,右—C;乙池中:左—Fe,右—C
(2)装置丙中由于a点既与电解液接触,又与空气接触,故易生锈。装置丁中铁屑发生吸氧腐蚀,负极:Fe-2e-=Fe2+,正极:O2+4e-+2H2O=4OH-,生成的离子继续反应:Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3,2Fe(OH)3=Fe2O3·xH2O+(3-x)H2O,由整个反应来看,最终铁屑表面会生成红棕色的铁锈,由于反应消耗氧气,因此试管内液面上升。
故答案为:a;生铁表面生成红棕色锈斑,试管内液面上升.

 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
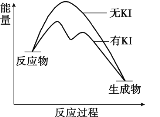
A加金题 系列答案【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。
t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性