题目内容
【题目】化学反应原理对于研究化学物质有十分重要的意义。
(1)已知次磷酸(H3PO2,一元中强酸)和亚磷酸(H3PO3,结构式为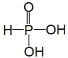 ,二元中强酸)均是重要的精细化工产品。
,二元中强酸)均是重要的精细化工产品。
①写出次磷酸的结构式:_____________________________________。
②已知某温度下0.01 mol·L-1的NaOH溶液pH=10,将该NaOH溶液与等浓度等体积的次磷酸溶液混合,混合后溶液pH=7,则此时c(OH-)—c(H3PO2)=___________。(用具体数值表示)
(2)实验室配制FeCl3溶液时,需要将FeCl3固体溶解在较浓的盐酸中,其原因是_______________________________________________________(用离子方程式和必要的文字说明)。
已知25℃时,Fe(OH)3的Ksp=4.0×10-38,配制100ml 5 mol·L-1的FeCl3溶液,至少需要加入_______mL 2 mol·L-1的盐酸(忽略加入盐酸的体积)。
(3)工业废水中的Cr2O72-对生态系统有很大损害。常用的处理方法有两种。
①还原沉淀法:Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3。常温下,要使Cr3+沉淀完全,溶液的pH应调至________。(已知Cr(OH)3的Ksp=10-32)
Cr(OH)3。常温下,要使Cr3+沉淀完全,溶液的pH应调至________。(已知Cr(OH)3的Ksp=10-32)
②电解法:用铁和石墨做电极,电解产生的还原剂将Cr2O72-还原成Cr3+,最终产生Cr(OH)3沉淀。若有1mol Cr2O72-被还原,理论上导线中通过___________mol电子。
【答案】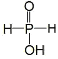 10-7 mol·L-1 ( Fe3++3H2O
10-7 mol·L-1 ( Fe3++3H2O![]() Fe(OH)3+3H+ 加入盐酸可以抑制Fe3+的水解 2.5 5 12
Fe(OH)3+3H+ 加入盐酸可以抑制Fe3+的水解 2.5 5 12
【解析】
(1)①在无机含氧酸中,酸电离出的H+皆来自于酸分子中羟基O-H键的断裂,故一般酸分子中有几个羟基,该酸就是几元酸;
②题中说明次磷酸是中强酸,则其形成的盐溶液中存在水解平衡,列出电荷守恒式、物料守恒式,再作差即可得到题中要求计算的数据;
(2)将FeCl3固体溶解在较浓的盐酸中,是因为盐酸可以抑制Fe3+的水解;题中说明忽略加入盐酸的体积,可认为溶液体积保持不变,根据溶度积的公式可以计算出溶液中OH-的浓度,从而得到H+的浓度,在根据H+的物质的量不变计算;
(3)①当c(Cr3+)≤ 1×10-5mol·L-1时,可认为Cr3+沉淀完全,根据溶度积的公式可以计算出溶液中OH-的浓度,从而得到H+的浓度和溶液pH;②需要认真读题,题中说明还原剂由电解而来,并非Cr2O72-发生电解反应,需要根据Cr2O72-的量来确定还原剂Fe2+的量,从而计算得出导线中通过电子的量。
(1)①含氧酸中的H+都是来自于羟基中O-H键的断裂,亚磷酸中含有两个羟基,故其是二元酸(尽管其含三个氢原子),故一元酸次磷酸含有一个羟基,则其结构式为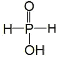 ;
;
②将NaOH溶液与等浓度等体积的次磷酸溶液混合得到NaH2PO2溶液,根据物料守恒有:c(Na+)=c(H3PO2)+c(H2PO2-),根据电荷守恒有:c(Na+)+c(H+)=c(H2PO2-)+c(OH-),将两个守恒式相减可得:c(OH-)-c(H3PO2)=c(H+),由于NaOH溶液和次磷酸溶液混合后溶液pH=7,即溶液中c(H+)=10-7mol·L-1,故c(OH-)-c(H3PO2)= 10-7mol·L-1;
(2)FeCl3溶液中有:Fe3++3H2O![]() Fe(OH)3+3H+,加入盐酸可以抑制Fe3+的水解;由于忽略加入盐酸的体积,所以溶液体积始终为100mL;c(Fe3+)·[c(OH-)]3=Ksp[Fe(OH)3],c(Fe3+)=5mol·L-1,故c(OH-)=
Fe(OH)3+3H+,加入盐酸可以抑制Fe3+的水解;由于忽略加入盐酸的体积,所以溶液体积始终为100mL;c(Fe3+)·[c(OH-)]3=Ksp[Fe(OH)3],c(Fe3+)=5mol·L-1,故c(OH-)=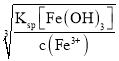 =
=![]() =2×10-13mol·L-1,则c(H+)=
=2×10-13mol·L-1,则c(H+)=![]() =
=![]() =0.05mol·L-1,根据H+的物质的量不变,V(HCl)=
=0.05mol·L-1,根据H+的物质的量不变,V(HCl)=![]() =0.0025L=2.5mL;
=0.0025L=2.5mL;
(3)①当c(Cr3+)≤ 1×10-5mol·L-1时,可认为Cr3+沉淀完全,由于c(Cr3+)·[c(OH-)]3=Ksp[Cr(OH)3],故c(OH-)= =
=![]() =1×10-9mol·L-1,则c(H+)=
=1×10-9mol·L-1,则c(H+)=![]() =
=![]() =1×10-5mol·L-1,即pH=-lg c(H+)=5;
=1×10-5mol·L-1,即pH=-lg c(H+)=5;
②根据反应6Fe2++Cr2O72-+11H2O=6Fe(OH)3↓+2Cr3++4H+可知,1mol Cr2O72-可被6mol Fe2+还原,而Fe2+由Fe放电失去两份电子产生,故1mol Cr2O72-被还原,导线中通过12mol电子。

 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。
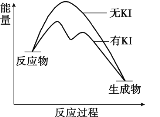
t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
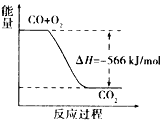
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性