题目内容
(15分)(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H=" -1275.6" kJ·mol-1
② H2O(l) H2O(g) △H=" +" 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
工业上可用如下方法合成甲醇:

方法一 方法二
①方法一:该反应的△S 0(填“>”或“<”)。图中曲线a到曲线b的措施是
,恒温恒容时,下列说法能说明反应到达平衡状态的是 。
A.体系的平均摩尔质量不再改变 B. V(CO)= V(CH3OH)
C. H2的转化率达到了最大限度 D. △H不再改变
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为: ;a,b两点化学反应速率别用Va、Vb表示,则Va Vb(填“大于”、“小于”或“等于”)。 已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法一的原子利用率是方法二的原子利用率的 倍(保留两位小数).
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出除去甲醇的离子方程式 。
① 2CH3OH(l)+3O2(g)
② H2O(l)
写出表示甲醇燃烧热的热化学方程式 。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
| 方法一 | CO(g) +2H2(g)  CH3OH(g) CH3OH(g) |
| 方法二 | CO2(g) +3H2(g)  CH3OH(g) +H2O(g) CH3OH(g) +H2O(g) |

方法一 方法二
①方法一:该反应的△S 0(填“>”或“<”)。图中曲线a到曲线b的措施是
,恒温恒容时,下列说法能说明反应到达平衡状态的是 。
A.体系的平均摩尔质量不再改变 B. V(CO)= V(CH3OH)
C. H2的转化率达到了最大限度 D. △H不再改变
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为: ;a,b两点化学反应速率别用Va、Vb表示,则Va Vb(填“大于”、“小于”或“等于”)。 已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法一的原子利用率是方法二的原子利用率的 倍(保留两位小数).
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出除去甲醇的离子方程式 。
(1)CH3OH(l)十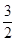 O2(g)
O2(g) CO2(g)+2H2O(l) △H= -725.8kJ/mol
(2)①< 加入催化剂、AC; ②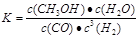 大于 1.56
大于 1.56
(3) 6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
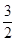 O2(g)
O2(g)(2)①< 加入催化剂、AC; ②
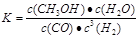 大于 1.56
大于 1.56 (3) 6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
试题分析:(1)甲醇的燃烧热是1mold的甲醇完全燃烧产生液态水和气态二氧化碳时所释放飞热量。根据题意可得燃烧热数值为1275.6 kJ/mol÷2+2×44.0 kJ.mol=725.8kJ/mol,所以燃烧热的化学方程式为CH3OH(l)十
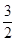 O2(g)
O2(g) CH3OH(g) +H2O(g)在a点时的平衡常数是
CH3OH(g) +H2O(g)在a点时的平衡常数是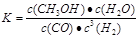 由于a,b两点对应的温度相同,CO2的转化率a>b,说明压强a>b,在其它条件不变时增大压强,物质的浓度增大,化学反应速率加快,所以Va>Vb表示;在方法一中由于反应物的原子全部转化为生成物,所以其原子利用率是100%;而方法二中原子利用率是32÷(32+18)×100%=64%.因此方法一的原子利用率是方法二的原子利用率的100% ÷64% =1.56。(3)根据题意可得Co3+除去甲醇的离子方程式是6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
由于a,b两点对应的温度相同,CO2的转化率a>b,说明压强a>b,在其它条件不变时增大压强,物质的浓度增大,化学反应速率加快,所以Va>Vb表示;在方法一中由于反应物的原子全部转化为生成物,所以其原子利用率是100%;而方法二中原子利用率是32÷(32+18)×100%=64%.因此方法一的原子利用率是方法二的原子利用率的100% ÷64% =1.56。(3)根据题意可得Co3+除去甲醇的离子方程式是6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
 N2↑+ 4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是( )
N2↑+ 4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是( )
 2SO3(g)
2SO3(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
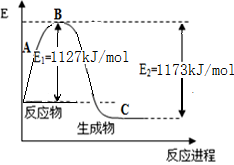
 (图中的
(图中的 表示生成1mol产物的数据)。根据下图回答下列问题:
表示生成1mol产物的数据)。根据下图回答下列问题:
 的热化学方程式为 。
的热化学方程式为 。 = KJ·mol-1
= KJ·mol-1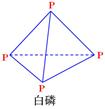 (P4O10)
(P4O10)