题目内容
下图是红磷P(s)和Cl2反应生成 (图中的
(图中的 表示生成1mol产物的数据)。根据下图回答下列问题:
表示生成1mol产物的数据)。根据下图回答下列问题:

(1) 的热化学方程式为 。
的热化学方程式为 。
(2) = KJ·mol-1
= KJ·mol-1
(3)研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单地理解为断开1mol化学键时所需吸收的能量,表1所列是部分化学键的键能数据。
表1部分化学键的键能数据
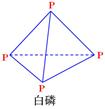
已知1mol白磷(结构如下图所示,分子式为P4)完全燃烧生成P4O10(结构如下图)放出2982KJ热量,则表中:x= 。
 (P4O10)
(P4O10)
 (图中的
(图中的 表示生成1mol产物的数据)。根据下图回答下列问题:
表示生成1mol产物的数据)。根据下图回答下列问题:
(1)
 的热化学方程式为 。
的热化学方程式为 。(2)
 = KJ·mol-1
= KJ·mol-1(3)研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单地理解为断开1mol化学键时所需吸收的能量,表1所列是部分化学键的键能数据。
表1部分化学键的键能数据
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ·mol-1) | 198 | 360 | 498 | x |
已知1mol白磷(结构如下图所示,分子式为P4)完全燃烧生成P4O10(结构如下图)放出2982KJ热量,则表中:x= 。
 (P4O10)
(P4O10)
(1)2PCl3(g)=2P(s)+3Cl2(g) △H=+612KJ·mol-1。 (2)-399。 (3)585
试题分析:(1)由物质的能量图示可知:PCl3(g)分解成P(s)和Cl2(g)的热化学方程式为2PCl3(g)=2P(s)+3Cl2(g) △H=+612KJ/mol。(2) P(s)和Cl2(g)分两步反应生成1molPCl5(g)的ΔH1=-399KJ/mol..由白磷变为P4O10,由二者的结构式可以看出要断裂6mol的P-P、5mol的O=O键。形成4mol的P=O键和12mol的P-O键。由于共放出2982KJ热量,由于断裂化学键吸收能量,形成化学键放出能量。所以+198KJ/mol×6mol+498KJ/mol×5mol-360KJ/mol×12mol-4x=-2982KJ。解得x=585KJ/mol.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 CH3OH(g)
CH3OH(g) 
 2NH3(g) ΔH="-92.4" kJ·mol-1,则N≡N键的键能是( )
2NH3(g) ΔH="-92.4" kJ·mol-1,则N≡N键的键能是( )