题目内容
20.将0.2mol某烷烃完全燃烧后生成的气体缓慢通入盛有0.5L 2mol/L的氢氧化钠溶液中,生成的碳酸钠与碳酸氢钠的物质的量之比为1:3,该烷烃为( )| A. | 丁烷 | B. | 乙烷 | C. | 甲烷 | D. | 丙烷 |
分析 据钠原子守恒计算出碳酸钠、碳酸氢钠的物质的量,再根据C原子守恒计算出生成二氧化碳的物质的量,然后根据烃的物质的量、二氧化碳的物质的量可确定该烷烃的分子式.
解答 解:设Na2CO3物质的量为xmol,NaHCO3物质的量为3xmol,
根据Na元素守恒得:n(Na+)=n(NaOH)=n(NaHCO3)+2n(Na2CO3),即:2x+3x=0.5L×2mol/L=1mol,
解得:x=0.2 mol,
由C元素守恒得:n(CO2)=x+3x=0.8 mol,
CnH2n+2~nCO2
1 n
0.2 mol 0.8 mol
则:n=$\frac{0.8mol×1}{0.2mol}$=4,
该烷烃分子中含有4个C,为丁烷,
故选A.
点评 本题考查有机物分子确定的计算,题目难度中等,注意掌握质量守恒在确定有机物分子式中的应用方法,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
12.某离子化合物中,阳离子和阴离子的电子层结构与氖原子的电子层结构相同,则此离子化合物的化学式为( )
| A. | MgO | B. | NaCl | C. | SiO2 | D. | K2S |
8.相对分子质量为142的脂环化合物M在氧气中燃烧只生成二氧化碳和水,M中含有一个六元环和氢氧化钠溶液反应生成两种有机产物.M不能与碳酸氢钠反应,则M分子环上一氯代物同分异构体有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
4.下列属于含极性键的非极性分子的是( )
| A. | H2S | B. | CCl4 | C. | C60 | D. | PH3 |

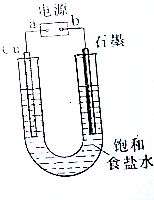 用如图所示装置电解饱和食盐水制Cl2、H2和NaOH.
用如图所示装置电解饱和食盐水制Cl2、H2和NaOH.