题目内容
12.某离子化合物中,阳离子和阴离子的电子层结构与氖原子的电子层结构相同,则此离子化合物的化学式为( )| A. | MgO | B. | NaCl | C. | SiO2 | D. | K2S |
分析 氖原子的核外电子数是10,则阳离子和阴离子的电子层结构均是10电子微粒,又为离子化合物,据此来分析.
解答 解:氖原子的核外电子数是10,则阳离子和阴离子的电子层结构均是10电子微粒;
A.氧化镁中氧离子和镁离子核外电子数都是10,又氧化镁为离子化合物,故A正确;
B.NaCl中钠离子核外有10个电子、Cl离子核外有18个电子,故B错误;
C.二氧化硅属于原子晶体,不属于离子化合物,故C错误;
D.硫化钾中钾离子核外有18个电子、硫离子核外有18个电子,故D错误;
故选A.
点评 本题考查了原子结构和元素性质,明确原子核外电子排布及原子结构即可解答,电子层结构相同的离子中电子数相等,题目难度不大.

练习册系列答案
相关题目
4.某有机物T的分子式为C5H12O4,0.1mol T与足量钠反应生成4.48L(标准状况)氢气.已知一个碳原子上连接两个-OH的有机物不稳定.则T的稳定结构(不考虑立体异构)有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
5.下列有机分子中,所有的原子不可能在同一个平面的是( )
| A. | CH2═CHCl | B. |  | ||
| C. |  | D. | CH3-CH═CH2 |
8.下列说法正确的是( )


| A. | 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定.当滴定到消耗20mlHCl时所得溶液中离子浓度间的关系有:5c(Cl-)═4c(HCO3-)+4c(CO32-)+4c(H2CO3) | |
| B. | 常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液中水的电离程度:③>①>② | |
| C. | 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:C(CH3COO-)>C(CH3COOH)>C(H+)>C(OH-) | |
| D. | 等体积等物质的量浓度的NaF溶液与NaCl溶液中离子总数:N(NaF)>N(NaCl) |
 某研究性学习小组的同学通过对亚硫酸钠组成元素的价态进行分析后认为Na2SO3溶液在存放过程中有可能变质,若已变质,则相应反应的化学方程式2Na2SO3+O2=2Na2SO4.
某研究性学习小组的同学通过对亚硫酸钠组成元素的价态进行分析后认为Na2SO3溶液在存放过程中有可能变质,若已变质,则相应反应的化学方程式2Na2SO3+O2=2Na2SO4.

 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)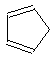 ,E的结构简式是CH3CHO.
,E的结构简式是CH3CHO.
 .
.