��Ŀ����
11��D��EΪ��ѧ��ѧ�����Ľ������ʣ���һ��������C��D���ܷ�����Ӧ��������ת����ϵ��ͼ��
��1��B��ͬ�������������Ϊ������H�Ļ�ѧʽΪ��Fe2��SO4��3��
��2��д��D��H��Ӧ�����ӷ���ʽ2Fe3++Cu=2Fe2++Cu2+��
��3���ö��Ե缫���A ��Һ��������ӦʽΪ��4OH--4e-=2H2O+O2����
��4������H��G�Ļ����Һ�к���G�������ӵ��Լ������ǣ�c��
a����ˮ��KSCN��Һ b������������Һ c������KMnO4��Һ
��5���ö��Ե缫���һ��Ũ�ȵ�A��Һ��ͨ��һ��ʱ�����������Һ�м���9.8g��A�н��������ӵ���������ǡ�ûָ������ǰ��Ũ�Ⱥ�pH�����������ת�Ƶ��ӵ����ʵ���Ϊ0.4mol���ռ�����״���µ��������Ϊ��4.48L��
���� ���A��Һ�����������ʣ���DΪ������AӦΪ�����ý����ĺ������Σ����ʱ�����������ɽ�����������Ӧ����O2������E����B��ȼ��˵��BΪO2��CӦΪ�����ᣬ��E�������з�Ӧ������Ϊ���ᷴӦ�����������Σ�˵������Ϊ��۽�������EӦΪFe����CӦΪ���ᣬ������Ϊ���ᣬ�������������������ᷴӦֻ����һ�����ʣ���GΪFeSO4��HΪFe2��SO4��3��DӦΪCu����AӦΪCuSO4�����������ʵ����ʺ���ĿҪ��ɽ����⣮
��� �⣺���A��Һ�����������ʣ���DΪ������AӦΪ�����ý����ĺ������Σ����ʱ�����������ɽ�����������Ӧ����O2������E����B��ȼ��˵��BΪO2��CӦΪ�����ᣬ��E�������з�Ӧ������Ϊ���ᷴӦ�����������Σ�˵������Ϊ��۽�������EӦΪFe����CӦΪ���ᣬ������Ϊ���ᣬ�������������������ᷴӦֻ����һ�����ʣ���GΪFeSO4��HΪFe2��SO4��3��DӦΪCu����AӦΪCuSO4��
��1�������Ϸ�����֪��BΪO2����Ӧ��ͬ��������Ϊ������HΪFe2��SO4��3���ʴ�Ϊ�������� Fe2��SO4��3��
��2��DΪCu��HΪFe2��SO4��3�����߷�Ӧ�����ӷ���ʽΪ2Fe3++Cu=2Fe2++Cu2+���ʴ�Ϊ��2Fe3++Cu=2Fe2++Cu2+��
��3��AӦΪ�����ý����ĺ������Σ����ʱ�����������ɽ�����������Ӧ����O2��������ӦʽΪ4OH--4e-=2H2O+O2�����ʴ�Ϊ��4OH--4e-=2H2O+O2����
��4��Fe2+���л�ԭ�ԣ��������Ը��������Һ����������ԭ��Ӧ�����ø�����ؼ��飬�ʴ�Ϊ��c��
��5����������Һ�м���9.8g��A�н��������ӵ�������壬��ΪCu��OH��2��Ϊ0.1mol��ǡ�ûָ������ǰ��Ũ�Ⱥ�pH��˵������0.1molCu��0.1molH2��0.1molO2��Ӧת�Ƶ���0.4mol���ռ�����״���µ��������Ϊ0.2mol��22.4L/mol=4.48L��
�ʴ�Ϊ��0.4��4.48L��
���� ���⿼��������ƶϣ���Ŀ�ѶȲ�����ע����յ����ص㣬����ӵ��ĽǶ������ƶϣ�ע��������Ԫ�ػ������֪ʶ���״���Ϊ��5����ע��������Һ�ı仯��

 ͬ��������ϰϵ�д�
ͬ��������ϰϵ�д� �ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
�ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�| A�� | ��״���£�11.2L CCl4����������Ϊ0.5NA | |
| B�� | 56g Fe�����������ᷴӦת�Ƶ�����Ϊ3NA | |
| C�� | 1mol��Ԫ��ת�������������������NA���������������� | |
| D�� | ���³�ѹ�£�46g��NO2��N2O4������庬�е�ԭ����Ϊ3NA |
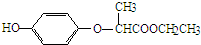
| A�� | ��1mol HPE����Һ�����Ժ�2molNaOH��Ӧ | |
| B�� | HPE���ܸ�Ũ��ˮ��Ӧ | |
| C�� | 1molHPE����4molH2�����ӳɷ�Ӧ | |
| D�� | HPE�����������12��ԭ�ӹ�ƽ�� |
| A�� | �ѽ���������ϡ������ 2Fe+6H+=2Fe3++3H2�� | |
| B�� | ��Ca��ClO��2��Һ��ͨ��������� Ca2++2ClO-+SO2+H2O=CaSO3��+2HClO | |
| C�� | ��Ca��HCO3��2��Һ�м�������������������Һ Ca2++HCO3-+OH-=CaCO3��+H2O | |
| D�� | ��NH4HSO4ϡ��Һ����μ���Ba��OH��2��Һ���պó�����ȫ��NH4++H++SO42-+Ba2++2OH-=NH3•H2O+BaSO4��+H2O |
| A�� | �ö��Ե缫��ⱥ���Ȼ�����Һ��2Cl-+2H+ $\frac{\underline{\;���\;}}{\;}$H2��+Cl2�� | |
| B�� | �ô����ȥˮ����CaCO3+2H+�TCa2++H2O+CO2�� | |
| C�� | ���ø�ʴ������ӡˢ��·�壺2Fe3++Cu�T2Fe2++Cu2+ | |
| D�� | ʵ������Һ��ͱ��ڴ������������屽�� |
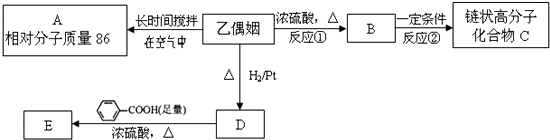
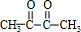
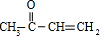 $\stackrel{һ��������}{��}$
$\stackrel{һ��������}{��}$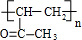
 $��_{��}^{Ũ����}$
$��_{��}^{Ũ����}$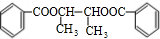 +2H2O��
+2H2O��