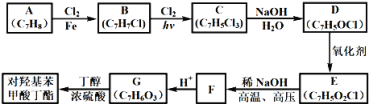
题目内容
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成![]() ,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
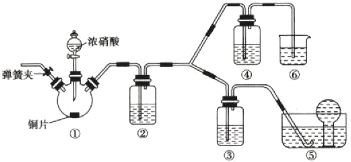
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与![]() 反应:
反应:![]() 。
。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是_______________________________________。
(2)滴加浓硝酸之前的操作是检查装置的气密性,加入药品,打开弹簧夹后_______________________________________。
(3)装置①中发生反应的化学方程式是____________________________________________。
(4)装置②的作用是_____________________,发生反应的化学方程式是________________________________________。
(5)该小组得出的结论所依据的实验现象是_________________________________________。
【答案】3mol/L稀硝酸、浓硝酸、氢氧化钠溶液 通入![]() 一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内
一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内 ![]() 将
将![]() 转化为NO
转化为NO ![]() 装置③中液面上方的气体仍为无色,装置④中液面上方的气体由无色变为红棕色
装置③中液面上方的气体仍为无色,装置④中液面上方的气体由无色变为红棕色
【解析】
(1)结合实验目的,根据装置特点分析各装置的作用,再根据物质的性质的判断;
(2)装置中残存的空气能氧化NO而对实验产生干扰;
(3)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O;
(4)根据实验目的及装置图可知,装置②产生NO;
(5)根据对比实验与性质判断装置③、④的实验现象。
(1)根据装置特点和实验目的,装置⑤是收集NO,装置⑥中盛放NaOH溶液吸收NO2,因为要验证稀HNO3不能氧化NO,所以装置③中应该盛放稀硝酸,④盛放浓硝酸,生成二氧化氮气体,应用氢氧化钠溶液吸收,故答案为:3mol/L稀硝酸、浓硝酸、氢氧化钠溶液;
(2)由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出,故答案为:通入![]() 一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内;
一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内;
(3)装置①中是Cu与浓HNO3反应,所以反应的化学方程式是 Cu+4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O,故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(4)根据实验目的,装置①中没有生成NO,故装置②中可以盛放H2O,使NO2与H2O反应生成NO:3NO2+H2O=2HNO3+NO,故答案为:将![]() 转化为NO;3NO2+H2O=2HNO3+NO;
转化为NO;3NO2+H2O=2HNO3+NO;
(5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明之,装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体,故答案为:④中液面上方气体变为红棕色,③中液面上方气体不变色。