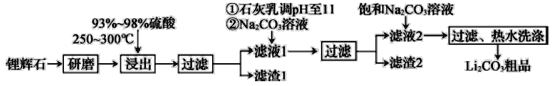
题目内容
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如图:
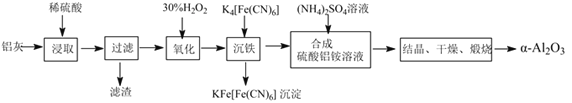
(1)铝灰中氧化铝与硫酸反应的化学方程式为___。
(2)图中“滤渣”的主要成分为___(填化学式)。加30%的H2O2溶液发生的离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为___。
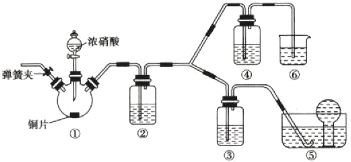
(4)煅烧硫酸铝铵晶体,发生的主要反应为4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过如图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过如图所示的装置。

①集气瓶中收集到的气体是___(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有__(填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为___。
【答案】Al2O3+3H2SO4=Al2(SO4)3+3H2O SiO2 静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有。或加KSCN溶液 N2 SO3、NH3 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
【解析】
铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),加入稀硫酸浸取,只有SiO2不溶而成为滤渣;加入30%H2O2,将Fe2+氧化为Fe3+,加入K4[Fe(CN)6]溶液,生成KFe[Fe(CN)6]蓝色沉淀;加入(NH4)2SO4,Al3+转化为NH4Al(SO4)2,再蒸发结晶,便可获得[NH4Al(SO4)2·12H2O,煅烧后得到![]() -Al2O3。
-Al2O3。
(1)铝灰中氧化铝与硫酸反应生成硫酸铝和水,化学方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O。答案为:Al2O3+3H2SO4=Al2(SO4)3+3H2O;
(2)由以上分析可知,图中“滤渣”的主要成分为SiO2。答案为:SiO2;
(3)验证“沉铁”后,溶液中是否还含有铁离子,可使用K4[Fe(CN)6]溶液检验,操作方法为静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有。或加KSCN溶液,观察溶液是否变为血红色;答案为:静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有。或加KSCN溶液;
(4)煅烧后,所得气体为NH3、N2、SO3、SO2,通过NaHSO3溶液,可吸收SO3和NH3;通过KMnO4溶液,可吸收SO2,最后剩余N2和水蒸气,用排水法收集,气体主要为N2。
①集气瓶中收集到的气体是N2。答案为:N2;
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有SO3、NH3。答案为:SO3、NH3;
③KMnO4溶液褪色(MnO4-还原为Mn2+),则MnO4-与SO2反应生成Mn2+、SO42-等,发生的离子反应方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。答案为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案