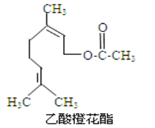
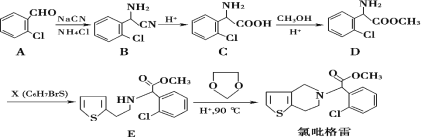
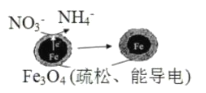
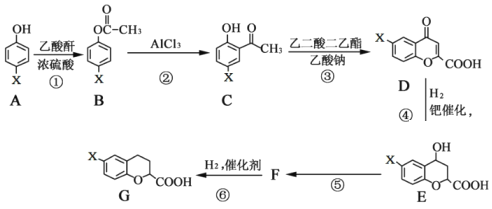
��Ŀ����
����Ŀ��A��B��CΪ������Ԫ�أ������ڱ���������λ����ͼ��ʾ��A��C��Ԫ�ص�ԭ�Ӻ��������֮�͵���Bԭ�ӵ���������Bԭ�Ӻ�������������������ȡ�

��1��д��Ԫ��A�����ƣ�______________��C��Ԫ�����ڱ��е�λ����______________��
��2��B��ԭ�ӽṹʾ��ͼΪ______________��C���⻯����B���⻯����ȶ���ǿ��˳��Ϊ______________��
��3���Ƚ�A��C��ԭ�Ӱ뾶��A______________���>����<����C��д��A����̬�⻯����A������������Ӧ��ˮ���ﷴӦ�Ļ�ѧ����ʽ��______________��
���𰸡��� �ڶ����ڵ�VIIA�� ![]() HF>H2S ��
HF>H2S ��
NH3��HNO3=NH4NO3
��������
����Ԫ�����ڱ���Ԫ�ص�λ�ã�A��ԭ������Ϊa����CΪa+2��BΪa+1+8��A��C��Ԫ�ص�ԭ�Ӻ��������֮�͵���Bԭ�ӵ�����������a+a+2=a+1+8��a=7����AΪN��BΪS��CΪF��
(1)Ԫ��AΪN��������Ϊ����CΪF��λ�ڵڶ�����VIIA�壻
(2)BΪS��ԭ�ӽṹʾ��ͼΪ![]() ��B��C���⻯��ֱ�ΪH2S��HF��F�ķǽ����Ա�Sǿ����C���⻯����B���⻯����ȶ���ǿ��˳��ΪHF��H2S��
��B��C���⻯��ֱ�ΪH2S��HF��F�ķǽ����Ա�Sǿ����C���⻯����B���⻯����ȶ���ǿ��˳��ΪHF��H2S��
(3)A��CΪͬ����Ԫ�أ�����Խ�뾶ԽС��ԭ�Ӱ뾶��A��C��AΪ�����⻯��Ϊ����������������Ӧˮ����Ϊ���ᣬ��Ӧ��������泥�����ʽΪNH3��HNO3=NH4NO3��

 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�