题目内容
【题目】硫酸在生活和生产中应用广泛。某工厂以黄铁矿(主要成分为FeS2)为原料,采用接触法制备硫酸。
(1)已知在298 K和101 kPa条件下:
FeS2(s)=FeS(s)+S(s) H1
S(s)+ O2(g)=SO2(g) H2
4FeS(s)+7O2(g)=2Fe2O3(s) +4SO2(g) H3
则在该条件下FeS2与O2生成Fe2O3和SO2的热化学方程式为_______。
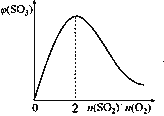
(2)催化氧化反应:2SO2(g) +O2(g)![]() 2SO3(g) H<0。在体积可变的密闭容器中,维持压强为101 kPa和初始n(SO2)=2mol,充入一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图所示:
2SO3(g) H<0。在体积可变的密闭容器中,维持压强为101 kPa和初始n(SO2)=2mol,充入一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图所示:
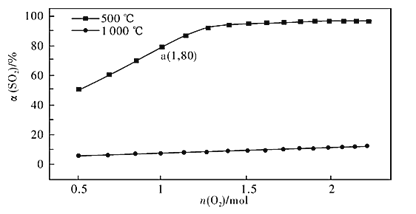
①在1000℃时,SO2平衡转化率随着O2物质的量的增大缓慢升高,解释其原因________。
②a点时SO3的平衡分压p(SO3)=_________Pa(保留两位有效数字,某组分的平衡分压=总压×某组分的物质的量分数)。
(3)保持温度不变,向固定体积的密闭容器中充入一定量的SO2、O2。请画出平衡体系中SO3的体积分数φ(SO3)随初始SO2、O2的物质的量之比[n(SO2)/n(O2)]的变化趋势图______:
(4)已知活性氧可以把SO2快速氧化为SO3,根据计算机模拟结果,在炭黑表面上O2转化为活性氧的反应历程与能量变化关系如图所示。下列说法不正确的是_______(填字母代号)。
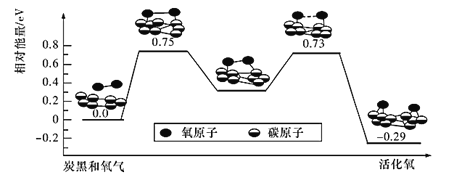
A.O2转化为活性氧是氧氧键的断裂与碳氧键的生成过程
B.该过程的最大能垒(活化能)E正=0.73 eV
C.每活化一个O2分子最终吸收0. 29 eV能量
D.依题炭黑可以作为SO2转化为SO3的催化剂
E.其他条件相同时,炭黑颗粒越小,反应速率越快
(5)硫酸工厂尾气中的SO2可被NaOH溶液吸收,用惰性电极将所得的Na2SO3溶液进行电解,可循环再生NaOH的同时得到H2SO4,写出阳极的电极反应式:___________
【答案】4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) H=2H1+2H2+H3 该反应H<0,1000![]() 时,该反应的平衡常数很小,二氧化硫的平衡转化率很小;1000
时,该反应的平衡常数很小,二氧化硫的平衡转化率很小;1000![]() 时,恒压条件下,充入氧气,c(SO2)和c(SO3)等倍数减,c(O2)增大,Qc=
时,恒压条件下,充入氧气,c(SO2)和c(SO3)等倍数减,c(O2)增大,Qc=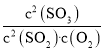 <K,平衡正向移动,二氧化硫的平衡转化率增大;
<K,平衡正向移动,二氧化硫的平衡转化率增大; ![]()
 BC SO32-+H2O-2e-=SO42-+2H+
BC SO32-+H2O-2e-=SO42-+2H+
【解析】
(1)①FeS2(s)=FeS(s)+S(s) H1;②S(s)+ O2(g)=SO2(g) H2;
③4FeS(s)+7O2(g)=2Fe2O3(s) +4SO2(g) H3;根据盖斯定律,①×2+②×2+③得热化学反应方程式为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) H=2H1+2H2+H3;故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) H=2H1+2H2+H3;
(2)①该反应H<0,1000![]() 时,根据二氧化硫的转化曲线,该反应的平衡常数很小,二氧化硫的平衡转化率很小;1000
时,根据二氧化硫的转化曲线,该反应的平衡常数很小,二氧化硫的平衡转化率很小;1000![]() 时,恒压条件下,充入氧气,c(SO2)和c(SO3)等倍数减,c(O2)增大,Qc=
时,恒压条件下,充入氧气,c(SO2)和c(SO3)等倍数减,c(O2)增大,Qc=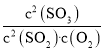 <K,平衡正向移动,二氧化硫的平衡转化率增大;故答案为:该反应H<0,1000
<K,平衡正向移动,二氧化硫的平衡转化率增大;故答案为:该反应H<0,1000![]() 时,该反应的平衡常数很小,二氧化硫的平衡转化率很小;1000
时,该反应的平衡常数很小,二氧化硫的平衡转化率很小;1000![]() 时,恒压条件下,充入氧气,c(SO2)和c(SO3)等倍数减,c(O2)增大,Qc=
时,恒压条件下,充入氧气,c(SO2)和c(SO3)等倍数减,c(O2)增大,Qc=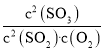 <K,平衡正向移动,二氧化硫的平衡转化率增大;
<K,平衡正向移动,二氧化硫的平衡转化率增大;
②

SO3的平衡分压p(SO3)=![]() ,故答案为:
,故答案为:![]() ;
;
(3)保持温度不变,向固定体积的密闭容器中充入一定量的SO2、O2,二氧化硫与氧气比例为2:1时,三氧化硫的平衡体积分数最大,故答案为: ;
;
(4)A. 由图分析可知,O2转化为活性氧是氧氧键的断裂与碳氧键的生成过程,A正确;
B. 该过程的最大能垒(活化能)E正=0.75eV,B错误;
C. 每活化一个O2释放0. 29 eV能量,C错误;
<>D. 炭黑可以提供活化氧,可作为SO2转化为SO3的催化剂,D正确;E. 其他条件相同时,炭黑颗粒越小,反应接触面积越大,反应速率越快,E正确;故答案为:BC;
(5)用惰性电极将所得的Na2SO3溶液进行电解,可循环再生NaOH的同时得到H2SO4,阳极是亚硫酸根离子失去电子,生成硫酸根离子,即阳极的电极反应为:SO32-+H2O-2e-=SO42-+2H+;故答案为:SO32-+H2O-2e-=SO42-+2H+。

【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
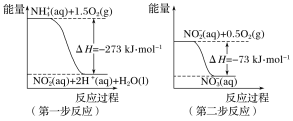
①第一步反应是________(填“放热”或“吸热”)反应,判断依据是________________。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________________。
(2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+0.5O2(g) ΔH=-226kJ·mol-1②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为________________。
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=______________。