题目内容
【题目】关于如图中各装置的叙述正确的是( )
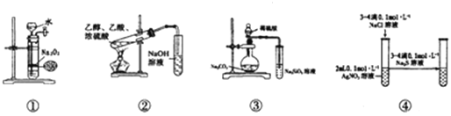
A.装置①可制备少量氧气
B.装置②可用于实验室制取和收集乙酸乙酯
C.装置③的实验可推断硫、碳、硅三种元素的非金属强弱
D.装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
【答案】C
【解析】
A.过氧化钠为粉末状,且与水反应剧烈,不能控制反应,A错误;
B.乙酸乙酯在氢氧化钠溶液中可完全水解,应用饱和碳酸钠溶液,B错误;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,根据反应现象,硫酸与碳酸钠反应生成二氧化碳,二氧化碳通入硅酸钠溶液中生成硅酸,可比较非金属性强弱,C正确;
D.硝酸银过量,加入硫化钠后肯定生成Ag2S沉淀,不能证明AgCl和Ag2S的溶解度大小,D错误。
故选:C。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目