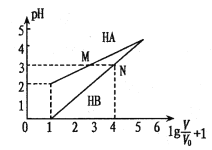
题目内容
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半,下列说法正确的是( )
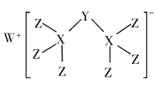
A.氧化物对应的水化物的酸性:Z> Y> X
B.元素X可与元素W形成化合物W2X,该化合物与水能产生可燃气体
C.该新化合物中Y不满足8电子稳定结构
D.Z氢化物的沸点一定比X氢化物的佛点高.
【答案】D
【解析】
W、X、Y、Z为同一短周期元素,根据图知,X能形成4个共价键、Z能形成1个共价键,则X位于第IVA族、Z位于第VIIA族,且Z核外最外层电子数是X核外电子数的一半,Z最外层7个电子,则X原子核外有14个电子,X为Si元素,Z为Cl元素,该阴离子中Cl元素为-1价、X元素为+4价,根据化合价的代数和为-1价可知,Y为-3价,所以Y为P元素,根据阳离子所带电荷知,W为Na元素。
A. Z为Cl、Y为P、X为Si,最高价氧化物对应的水化物依次为:HClO4、H3PO4、H2SiO3,其酸性为:HClO4>H3PO4>H2SiO3,A错误;
B. X为Si、W为Na,形成化合物Na4Si,与水反应生成氢气,其化学反应方程式为:Na4Si + 5H2O = Na2SiO3 + 2NaOH + 4H2 ↑,B错误;
C. Y为P,其最外层有5个电子,P原子形成2个共价键且该阴离子得到W原子一个电子,所以P原子达到8电子结构,C错误;
D. Z为Cl、X为Si,其对应的氢化物分别为:HCl、SiH4,沸点:HCl>SiH4,D正确;
答案为D。

【题目】新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高电子层符号为__,该电子层具有的原子轨道数为__。
②LiBH4由Li+和BH4-构成,BH4-的立体构型是__,B原子的杂化轨道类型是___。
③Li、B元素的电负性由小到大的顺序为___。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+__H-(填“>”“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是__族元素。
(3)图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和涂“![]() ”分别标明B与N的相对位置___。
”分别标明B与N的相对位置___。
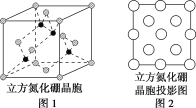
(4)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为__,NaH的理论密度是__g·cm-3(保留3个有效数字)。