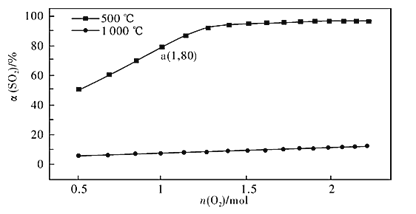
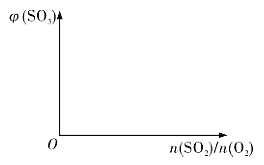
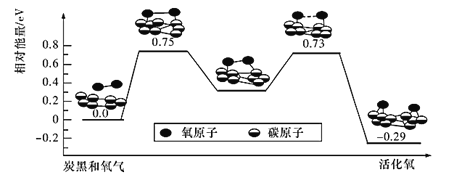
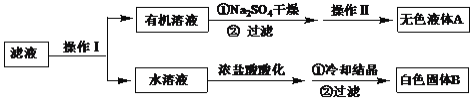题目内容
【题目】中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。已知:铟与铝(13Al)同主族。下列说法错误的是( )
A.In的金属性大于Al
B.In最外层有2种能量的电子
C.![]() In的中子数为66
In的中子数为66
D.![]() In原子的相对原子质量为115
In原子的相对原子质量为115
【答案】D
【解析】
A、同一主族元素的金属性随着原子序数的增大而增强;
B、铟与铝(13Al)同主族,则In的最外层电子数为3,排布在s、p轨道上;
C、中子数=质量数-质子数,据此计算判断;
D、![]() 的质量数为115。
的质量数为115。
A、铟与铝(13Al)同主族,并且铟元素的原子序数较大,同主族从上至下金属性逐渐增加,所以In的金属性强,故A不符合题意;
B、In的最外层电子数为3,排布在5s、5p轨道上,5s能级上两个电子能量相同,但小于5p能级上的电子能量,所以In最外层有2种能量的电子,故B不符合题意;
C、![]() 的质量数为115、质子数为49,所以中子数=119-49=66,故C不符合题意;
的质量数为115、质子数为49,所以中子数=119-49=66,故C不符合题意;
D、![]() 的质量数为115,In的相对原子质量为天然存在的核素In的质量数与其丰度的乘积之和,故D符合题意;
的质量数为115,In的相对原子质量为天然存在的核素In的质量数与其丰度的乘积之和,故D符合题意;
故选:D。

 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高电子层符号为__,该电子层具有的原子轨道数为__。
②LiBH4由Li+和BH4-构成,BH4-的立体构型是__,B原子的杂化轨道类型是___。
③Li、B元素的电负性由小到大的顺序为___。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+__H-(填“>”“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是__族元素。
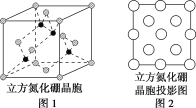
(3)图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和涂“![]() ”分别标明B与N的相对位置___。
”分别标明B与N的相对位置___。
(4)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为__,NaH的理论密度是__g·cm-3(保留3个有效数字)。
【题目】(环境污染与资源短缺问题日益突出,资源的循环利用尤为重要。工业 上利用含 Cu2O(含少量 Al2O3、Fe2O3 和 SiO2)的矿渣提取铜的工艺流程如下:
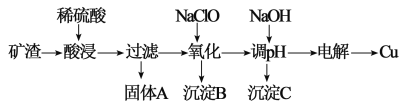
已知:①Cu2O 在酸性条件下易转化成单质 Cu 和含 Cu2+的溶液;
②几种氢氧化物沉淀时的 pH 如下表:
氢氧化物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
沉淀时的 pH | 4.0~5.2 | 5.8~8.8 | 1.1~3.2 | 5.4~6.7 |
回答下列问题:
(1)经检测固体 A 含有的成分为 Cu 和另一种杂质,从固体 A 中分离出 Cu 的可 用试剂为_____溶液(填化学式)。
(2)矿渣经酸浸、过滤、洗涤后铁元素的主要存在形式为__________填离子符号),检验该离子的常用化学试剂是_________________。
(3)加 NaClO 氧化并调整溶液的 pH 为_____,得到沉淀 B 和一种具有漂白 性的物质 D,该反应离子方程式为_________。
(4)25℃时,加 NaOH 固体调节溶液 pH 得到 Al(OH)3 沉淀,若 pH=5.3 时,所得 溶液中 c(Al3+)=_____。已知 25℃时 Ksp[Al(OH)3]=1.3×10-33。
(5)用惰性电极电解获得金属铜时,起始阶段阳极产物与阴极产物的物质的量之比为___________。