题目内容
10.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,
用化学符号回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序是Na>Al>O
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
 .
.(4)用电子式表示⑤⑧两种元素化合物的形成过程
 .
.(5)写出⑤、⑥两种元素的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4.
分析 由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)电子层越多半径越大,电子层相同时核电荷数越大半径越小;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)④、⑤可形成既含离子键又含非极性共价键的某化合物为Na2O2;
(4)⑤⑧两种元素化合物为NaCl,为离子化合物;
(5)⑤、⑥两种元素的最高价氧化物对应水化物反应,生成偏铝酸钠和水;
(6)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,即选择过氧化氢分解反应中的催化剂.
解答 解:由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)电子层越多半径越大,所以Na、Al>O,电子层一样多的原子,核电荷数越多半径越小,即Na>Al,故答案为:Na>Al>O;
(2)非金属性N>C>Si,则最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(3)④、⑤可形成既含离子键又含非极性共价键的某化合物为Na2O2,其电子式为 ,故答案为:
,故答案为: ;
;
(4)⑤⑧两种元素化合物为NaCl,为离子化合物,电子式表示形成过程为 ,故答案为:
,故答案为: ;
;
(5)⑤、⑥两种元素的最高价氧化物对应水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(6)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,化合物为过氧化氢,可在a或b催化作用下分解,故答案为:ab.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素化合物性质为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

| A. | X是第二周期元素 | B. | Y是第ⅦA族元素 | ||
| C. | Y-与X2+的最外层电子数相同 | D. | 化合物XY2的化学键为离子键 |
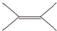 的二氯代物有( )
的二氯代物有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 6个碳原子都在一条直线上 | B. | 有可能5个碳原子在一条直线上 | ||
| C. | 6个碳原子都在同一平面上 | D. | 6个碳原子不可能在同一平面上 |
| A. | 晶体根据结构和性质只可分为分子晶体,原子晶体,离子晶体和金属晶体四大类 | |
| B. | 含有阳离子的晶体一定是离子晶体,且离子晶体中可能含有共价键 | |
| C. | 任何晶体中部分含有化学键,如离子键、共价键、金属键、氢键等 | |
| D. | 原子晶体的熔沸点不一定高于离子晶体,而离子晶体的熔沸点肯定高于分子晶体 |
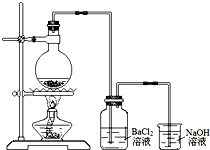 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.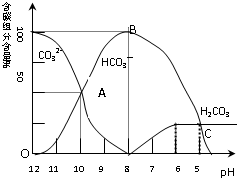 常温下在20mL0.1mol/L碳酸钠溶液中逐滴加入0.1mol/L盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒的百分含量也发生变化(二氧化碳因为逸出未画出).据此回答下列问题:
常温下在20mL0.1mol/L碳酸钠溶液中逐滴加入0.1mol/L盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒的百分含量也发生变化(二氧化碳因为逸出未画出).据此回答下列问题: A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).
A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).