题目内容
15.下列关于化合物CH3-CH=CH-C≡C-CH3说法中,正确的是( )| A. | 6个碳原子都在一条直线上 | B. | 有可能5个碳原子在一条直线上 | ||
| C. | 6个碳原子都在同一平面上 | D. | 6个碳原子不可能在同一平面上 |
分析 根据碳碳双键为平面结构、碳碳三键为直线结构,与双键碳直接相连的原子一定在同一平面内,以此来解答.
解答 解:分子中碳链空间结构为平面型,如图所示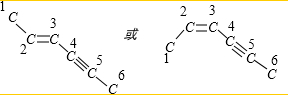 .
.
乙炔为直线型结构,-C≡C-决定了3、4、5、6号4个碳原子在同一直线上,2、3、4号3个C有健角接近120度,
所以6个碳原子不可能都在一条直线上,4个碳原子在一条直线上;
乙烯为平面型结构, 决定1、2、3、4号4个碳原子在同一平面内,而3、4、5、6号4个碳原子在同一直线上,3、4号两个C原子已经在平面上,因此这条直线在这个平面上,6个C原子共面,且与C=C、C≡C直接相连的原子在同一平面内,则6个C、还有4个H在同一平面内,
决定1、2、3、4号4个碳原子在同一平面内,而3、4、5、6号4个碳原子在同一直线上,3、4号两个C原子已经在平面上,因此这条直线在这个平面上,6个C原子共面,且与C=C、C≡C直接相连的原子在同一平面内,则6个C、还有4个H在同一平面内,
故选C.
点评 本题主要考查有机化合物的结构特点,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构,题目难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
5.下列烯烃中存在顺反异构体的是( )
| A. | 丙烯 | B. | 1-丁烯 | C. | 2-戊烯 | D. | 2-甲基-2-丁烯 |
7.下列关于化学用语的表示正确的是( )
| A. | 过氧化钠的电子式: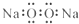 | |
| B. | 硫离子的结构示意图: | |
| C. | NH4Cl的电子式: | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
4.如图是元素周期表的一部分.
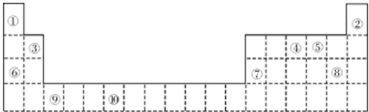
(1)元素⑤的未成电子数为2.
(2)如果在温度接近373K时,根据M=$\frac{m}{n}$测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是分子间存在氢键,H2O分子发生缔合
(3)要证明太阳上是否含有②元素,可采用的方法是光谱分析.
(4)某些不同族元素的性质也有一定的相似性,加上表中元素⑦与元素③的氢氧化物有相似的性质.写出元素③的氢氧化物与NaOH溶液反应的离子方程式2OH-+Be(OH)2=BeO22-+2H2O.
(5)根据下列五种元素的第一至第四电力能数(单位:kJ•mol-1).回答下面各题:
(Ⅰ)在周期表中,最可能处于同一主族的是R和U(填匀速代号)
(Ⅱ)T元素最可能是p(填“s”、“p”、“d”、“ds”等)区元素,位于IIIA族;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为120°.
(6)⑩元素M能形成化合物(MO2Cl2).请回答下列问题:
(Ⅰ)与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有K、Cu(填元素符号)
(Ⅱ)MO2Cl2常温下为深红色液体,能与CCl2、CS2等互溶,据此可判断MO2Cl2是非极性(填“极性”或“非极性”)分子.

(1)元素⑤的未成电子数为2.
(2)如果在温度接近373K时,根据M=$\frac{m}{n}$测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是分子间存在氢键,H2O分子发生缔合
(3)要证明太阳上是否含有②元素,可采用的方法是光谱分析.
(4)某些不同族元素的性质也有一定的相似性,加上表中元素⑦与元素③的氢氧化物有相似的性质.写出元素③的氢氧化物与NaOH溶液反应的离子方程式2OH-+Be(OH)2=BeO22-+2H2O.
(5)根据下列五种元素的第一至第四电力能数(单位:kJ•mol-1).回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
(Ⅱ)T元素最可能是p(填“s”、“p”、“d”、“ds”等)区元素,位于IIIA族;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为120°.
(6)⑩元素M能形成化合物(MO2Cl2).请回答下列问题:
(Ⅰ)与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有K、Cu(填元素符号)
(Ⅱ)MO2Cl2常温下为深红色液体,能与CCl2、CS2等互溶,据此可判断MO2Cl2是非极性(填“极性”或“非极性”)分子.
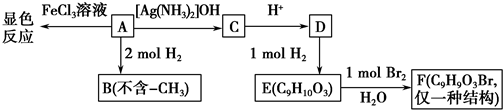
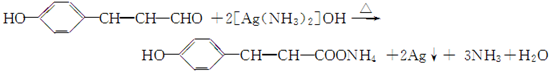 .
. .
. ,G的结构简式为:
,G的结构简式为: .
. .
. 或
或 (写出一个反应方程式即可).
(写出一个反应方程式即可).
 .
. .
.