题目内容
2.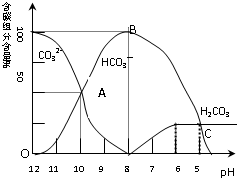 常温下在20mL0.1mol/L碳酸钠溶液中逐滴加入0.1mol/L盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒的百分含量也发生变化(二氧化碳因为逸出未画出).据此回答下列问题:
常温下在20mL0.1mol/L碳酸钠溶液中逐滴加入0.1mol/L盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒的百分含量也发生变化(二氧化碳因为逸出未画出).据此回答下列问题:(1)用离子方程式表示碳酸钠溶液呈碱性的原因:CO32-+H2O?HCO3-+OH-
(2)当加入盐酸使溶液pH为10时,混合液中含碳元素的离子的物质的量之比为n(CO32-):n(HCO3-)=1:1
(3)用等式表示碳酸钠溶液中所有离子浓度之间的关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
(4)请写出OAB段的离子方程式:CO32-+H+=HCO3-
(5)当混合溶液的pH=6时,开始放出二氧化碳气体.
分析 (1)碳酸钠溶液中碳酸根离子存在水解平衡,根据水解原理来回答;
(2)根据图中的信息可以知道,当pH=10时,碳酸根离子和碳酸氢根离子的百分含量是相等的,据此回答;
(3)碳酸钠溶液中碳酸根离子水解,溶液显示碱性,据此确定溶液中各个离子浓度之间的关系;
(4)OAB段是溶液中的碳酸根离子和氢离子反应生成碳酸氢根离子的过程;
(5)碳酸氢根离子和氢离子反应生成二氧化碳,当二氧化碳得到溶解平衡便有二氧化碳放出.
解答 解:(1)碳酸钠溶液中碳酸根离子存在水解平衡:CO32-+H2O?HCO3-+OH-,所以溶液显示碱性,故答案为:CO32-+H2O?HCO3-+OH-;
(2)根据图中的信息可以知道,当pH=10时,碳酸根离子和碳酸氢根离子的百分含量是相等的,所以n(CO32-):n(HCO3-)=1:1;故答案为:n(CO32-):n(HCO3-)=1:1;
(3)碳酸钠溶液中碳酸根离子水解,溶液显示碱性,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故答案为:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-);
(4)OAB段是溶液中的碳酸根离子和氢离子反应生成碳酸氢根离子的过程,发生反应的离子方程式为:CO32-+H+=HCO3-;
故答案为:CO32-+H+=HCO3-;
(5)碳酸氢根离子和氢离子反应生成二氧化碳,当二氧化碳得到溶解平衡便有二氧化碳放出,即碳酸的百分含量保持不变时,此时pH=6.
故答案为:6.
点评 本题考查溶液离子浓度大小比较以及难溶电解质的溶解平衡及沉淀转化等问题,题目难度中等,注意分析图象曲线变化趋势,把握物质的性质是关键.

练习册系列答案
相关题目
12.在一定温度下,可逆反应X(g)+3Y(g)?2Z(g)达到平衡的标志是( )
| A. | X生成的速率与Z分解的速率相等 | |
| B. | 单位时间生成a molX,同时生成3a molY | |
| C. | X、Y、Z的分子数比为1:3:2 | |
| D. | X、Y、Z的浓度不再变化 |
13.下列关于胶体的叙述正确的是( )
| A. | 胶体都是无色、透明的 | |
| B. | 可以通过丁达尔现象鉴别胶体和溶液 | |
| C. | 可以用滤纸分离淀粉和KI的混合液 | |
| D. | 胶粒在电场作用下均会产生电泳现象 |
7.下列关于化学用语的表示正确的是( )
| A. | 过氧化钠的电子式: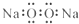 | |
| B. | 硫离子的结构示意图: | |
| C. | NH4Cl的电子式: | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
14.下列离子中,半径最大的是( )
| A. | S2- | B. | N3- | C. | Cl- | D. | Mg2+ |
11.下列有机物的系统命名中正确的是( )
| A. | 3-甲基-4-乙基戊烷 | B. | 2,3-二甲基戊烷 | ||
| C. | 3,4,4-三甲基已烷 | D. | 3,5-二甲基已烷 |
12.可能存在的第119号元素,有人称“类钫”,据周期表结构及元素性质变化趋势,有关“类钫”的预测正确的是( )
| A. | “类钫”属过渡元素,具有放射性 | B. | “类钫”可与水剧烈反应 | ||
| C. | “类钫”单质的密度小于1g/cm3 | D. | “类钫”单质有较高熔点 |

 .
. .
. D.CH3-CH2-CH2-CH3和
D.CH3-CH2-CH2-CH3和 E.液氯和氯气 F.CO(NH2)2和NH4CNOG.C60和金刚石
E.液氯和氯气 F.CO(NH2)2和NH4CNOG.C60和金刚石