题目内容
5.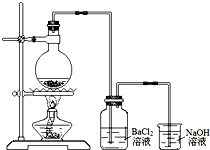 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.(1)铜和浓硫酸反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)实验结束后,发现广口瓶中产生白色沉淀,加入足量盐酸后沉淀几乎完全溶解.简要分析广口瓶中产生沉淀的主要原因:烧杯中的溶液倒吸入广口瓶中,与BaCl2溶液反应生成BaSO3沉淀.
(3)实验结束后,发现烧瓶中有铜片剩余.根据所学知识,他们认为烧瓶中还有较多的硫酸剩余.选择合适的试剂,设计简单易行的实验方案证明有余酸:取少量余液于试管中,加入足量Fe粉(或Na2CO3溶液),有气体产生证明有余酸.供选择的试剂:铁粉、银粉、BaCl2溶液、Na2CO3溶液
(4)甲同学设计如下方案:测定产生气体的量,再计算余酸的浓度.下列测定产生气体的量的实验方法中,不可行的是abc(填编号).
a.将气体缓缓通过预先称量、盛有碱石灰的干燥管,反应结束后再次称量
b.将气体通入硫酸酸化的KMnO4溶液,再加足量BaCl2溶液,过滤、洗涤、干燥,称量沉淀
c.用排水法测定产生气体的体积
d.用排饱和NaHSO3的方法测定产生气体的体积
(5)乙同学设计通过酸碱中和滴定来测定余酸的浓度:待烧瓶冷却至室温后,将其中的溶液用蒸馏水稀释至100mL,移取25mL到锥形瓶中,滴加2滴酚酞试液,用标准NaOH溶液滴至终点.平行实验三次.
①稀释时,应先往烧杯(填仪器名称)中加入蒸馏水(填“烧瓶中的溶液”或“蒸馏水”).
②该方法测得的余酸浓度偏大(填“偏大”、“偏小”或“准确”).
(6)丙设计了测定余酸浓度的较为简易的实验方案:取出反应后剩余的铜片,进行洗涤、干燥、称量.若称得剩余铜片的质量为3.2g,反应后溶液体积变化忽略不计,则剩余硫酸的物质的量浓度为8mol/L.
分析 (1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水;
(2)二氧化硫不与二氧化硫反应,但是二氧化硫容易与氢氧化钠溶液反应生成亚硫酸钠,若发生倒吸现象,则亚硫酸钠与钡离子反应生成亚硫酸钡沉淀;
(3)证明硫酸有剩余,需要证明反应后的溶液中含有大量氢离子,据此设计实验方案;
(4)碱石灰能吸收二氧化硫和水;硫酸酸化高锰酸钾后,影响了二氧化硫的测定;二氧化硫易溶于水,不能使用排水法测量气体体积,据此进行判断;
(5)①稀释浓硫酸时,应该将浓硫酸加入蒸馏水中;
②酚酞的变色范围为8-10,所以滴定终点时溶液的pH=8,则加入的氢氧化钠溶液比剩余溶液中氢离子的物质的量大,测定结果偏大;
(6)根据反应方程式可知,反应消耗的硫酸的物质的量是铜的2倍,据此可以计算出消耗的硫酸的浓度及剩余硫酸的物质的量浓度.
解答 解:(1)铜与浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)由于氯化钡不与二氧化硫反应,若生成了白色沉淀,该白色沉淀只能为亚硫酸钡,说明烧杯中的溶液倒吸入广口瓶中,亚硫酸钠与BaCl2溶液反应生成BaSO3沉淀,
故答案为:烧杯中的溶液倒吸入广口瓶中,与BaCl2溶液反应生成BaSO3沉淀;
(3)实验结束后,发现烧瓶中有铜片剩余,由于稀硫酸不与铜反应,则烧瓶中还有较多的硫酸剩余,证明硫酸有剩余,需要证明反应后的溶液中含有大量氢离子,可以用金属铁或碳酸钠溶液检验,方法为:取少量余液于试管中,加入足量Fe粉(或Na2CO3溶液),有气体产生证明有余酸,
故答案为:取少量余液于试管中,加入足量Fe粉(或Na2CO3溶液),有气体产生证明有余酸;
(4)a.将装置产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量,由于气体中含有水蒸气,碱石灰会吸收二氧化硫和水蒸气,称量后计算不准确,故a错误;
b.将气体通入硫酸酸化的KMnO4溶液,由于硫酸能够与氯化钡反应生成硫酸钡,干扰了二氧化硫的测定,所以不能用硫酸酸化高锰酸钾溶液,故b错误;
c.二氧化硫易溶于水,测量出的二氧化硫不准确,故c错误;
d.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积,二氧化硫在饱和NaHSO3溶液中的溶解度降低,可以用排水量气方法进行二氧化硫的气体体积测定,故d正确;
故答案为:abc;
(5)①浓硫酸密度大于水,稀释时放出大量热,所以稀释时,应先往烧杯中加入蒸馏水,然后再慢慢加入反应后烧杯中的溶液,
故答案为:烧杯;蒸馏水;
②用酚酞做指示剂,溶液变色时的pH=8>7,则滴定终点时加入的氢氧化钠稍过量,导致测定结果偏大,
故答案为:偏大;
(6)反应的铜的物质的量为:n(Cu)=$\frac{6.4g-3.2g}{64g/mol}$=0.05mol,
根据反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知,反应消耗的硫酸的物质的量是铜的2倍,则反应消耗的硫酸的物质的量为:0.05mol×2=0.1mol,
则反应消耗的硫酸的浓度为:$\frac{0.1mol}{0.01L}$=10mol/L,
所以反应后剩余硫酸的浓度为:18mol/L-10mol/L=8mol/L,
故答案为:8mol/L.
点评 本题考查了浓硫酸的化学性质、性质实验方案的设计,题目难度中等,明确实验目的为解答关键,注意掌握性质实验方案的设计原则及浓硫酸的性质,试题侧重考查学生的分析及化学实验、化学计算能力.

| A. | 0.05 | B. | 0.05mol/L | C. | 0.5 mol/(L.s) | D. | 0.05 mol/(L.s) |
| A. | 苯与Fe、Br2混合 | B. | 氯乙烷和NaOH溶液共热 | ||
| C. | 乙烯和溴水反应 | D. | 溴乙烷和NaOH的乙醇溶液共热 |
| A. | 胶体都是无色、透明的 | |
| B. | 可以通过丁达尔现象鉴别胶体和溶液 | |
| C. | 可以用滤纸分离淀粉和KI的混合液 | |
| D. | 胶粒在电场作用下均会产生电泳现象 |

| A. | 都能发生酯化反应 | |
| B. | 都能与NaOH反应 | |
| C. | 甲的苯环上的一氯代物有4种 | |
| D. | 丙的分子式为C10H15ON,能与酸反应 |
| A. | S2- | B. | N3- | C. | Cl- | D. | Mg2+ |

| A. | X的能量一定高于M | B. | 正反应为吸热反应 | ||
| C. | 该反应一定要加热后才能发生 | D. | 反应物总能量高于生成物总能量 |

 .
. .
. D.CH3-CH2-CH2-CH3和
D.CH3-CH2-CH2-CH3和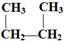 E.液氯和氯气 F.CO(NH2)2和NH4CNOG.C60和金刚石
E.液氯和氯气 F.CO(NH2)2和NH4CNOG.C60和金刚石