题目内容
3.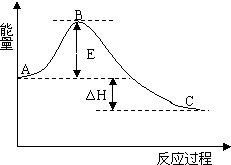 2SO2(g)+O2(g)=2SO3(g) 反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g) 反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:(1)由图知该反应向右方向为放热(填吸热或放热)反应,E的大小对该反应的反应热无(填有或无)无影响?该反应通常用V2O5作催化剂,加V2O5会使图中B点降低(填升高或降低)?
(2)图中△H=-198 kJ•mol-1;
(3)已知单质硫的燃烧热为296kJ•mo l-1,写出由S(s)生成SO3(g)的热化学方程式S(s)+3/2O2(g)=SO3(g)△H=-395kJ•mol-1.
分析 (1)反应向右时,反应物的总能量高于生成物的总能量;催化剂能够降低反应的活化能,不影响反应物和生成物能量高低;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(3)根据盖斯定律来分析.
解答 解:(1)反应向右时,反应物的总能量高于生成物的总能量,故反应放热;反应热取决于反应物和生成物的总能量的相对大小,与E的大小无关,故E的大小对反应的反应热无影响;催化剂能够降低反应的活化能,不影响反应物和生成物能量高低,故答案为:放热;无;降低;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,故答案为:-198;
(3)已知①S(s)+O2(g)=SO2(g)△H1=-296 KJ•mol-1,②SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H2=-99 KJ•mol-1;
则利用盖斯定律将①×3+②×3可得S(s)+3/2O2(g)=SO3(g)△H=-395kJ•mol-1,
故答案为:S(s)+3/2O2(g)=SO3(g)△H=-395kJ•mol-1.
点评 本题考查反应过程的能量变化图以及运用盖斯定律进行反应热的计算,难度不大,注意活化能与反应热的关系.

练习册系列答案
相关题目
1.2015年4月15日上午,扬州仪征市青山镇一家自来水厂发生氯气泄漏事故,附近两所学校及周围居民共千余人被紧急疏散,事故未造成人员伤亡.当人们逃离事故现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是( )
| A. | NaOH | B. | Na2CO3 | C. | Ca(OH)2 | D. | NaCl |
2.下列说法不正确的是( )
| A. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| B. | 用热的纯碱溶液去油污效果更好 | |
| C. | 制备无水的AlCl3、FeCl3均不能采用将溶液在空气中直接蒸干的方法 | |
| D. | 室温下,向0.1mol/L的HF溶液中加入少量水溶液显碱性的物质,HF的电离程度一定增大 |
11.若要配制480mL0.1mol/L的硫酸铜溶液,以下操作正确的是( )
| A. | 称取7.68g硫酸铜,加入500mL水 | B. | 称取12.5g胆矾配成500mL溶液 | ||
| C. | 称取8.0g硫酸铜,加入500mL水 | D. | 称取12.0g胆矾配成500mL溶液 |
18. 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生大量白色沉淀 |
| D | 氨水 | 硝酸银溶液 | 先产生白色沉淀后沉淀逐渐溶解 |
| A. | A | B. | B | C. | C | D. | D |
8.短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
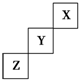

| A. | X、Y、Z三种元素中,与H2化合最容易的是X元素 | |
| B. | 最高价氧化物对应的水化物的酸性:Y>Z | |
| C. | Y的最高正化合价为+7价 | |
| D. | X单质的熔点比Z的低 |
15.2015年10月,屠哟哟因发现青篙素和双氢青篙素获诺贝尔生理学或医学奖,已知青蒿素的化学式为C15H22O5,则1mol青蒿素中氢原子的物质的量为( )
| A. | 1mol | B. | 15mol | C. | 22mol | D. | 5mol |
12.一滴水(约0.05mL)中大约有l.67×1021个水分子,由此最能说明分子具有的性质是( )
| A. | 分子在不断运动着 | B. | 分子间有一定间隔 | ||
| C. | 分子是由原子构成的 | D. | 分子的质量和体积都很小 |
13.下列物质属于高分子化合物的是( )
| A. | 果糖 | B. | 油脂 | C. | 蛋白质 | D. | 蔗糖 |