题目内容
2.下列说法不正确的是( )| A. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| B. | 用热的纯碱溶液去油污效果更好 | |
| C. | 制备无水的AlCl3、FeCl3均不能采用将溶液在空气中直接蒸干的方法 | |
| D. | 室温下,向0.1mol/L的HF溶液中加入少量水溶液显碱性的物质,HF的电离程度一定增大 |
分析 A.明矾电离产生的铝离子水解生成氢氧化铝胶体,具有吸附性;
B.盐类水解是吸热过程,加热促进盐的水解;
C.氯化铝、氯化铁水解生成氢氧化铁、氢氧化铝和氯化氢,氯化氢易挥发;
D.依据同离子效应解答.
解答 解:A.明矾电离产生的铝离子水解生成氢氧化铝胶体,具有吸附性,能够吸附水中杂质颗粒,故A正确;
B.油脂在碱性条件下更容易水解,碳酸钠水解生成亲氧化钠,且水解是吸热过程,加热促进盐的水解,碱性增强,故B正确;
C.氯化铝、氯化铁水解生成氢氧化铁、氢氧化铝和氯化氢,氯化氢易挥发,所以加热AlCl3、FeCl3得到氢氧化物,灼烧得到对应氧化物,故C正确;
D.室温下,向0.1mol/L的HF溶液中加入少量水溶液显碱性的物质,HF的电离程度不一定增大,例如加入氟化钠,增大氟离子浓度,抑制HF电离,故D错误;
故选:D.
点评 本题考查了元素化合物性质及用途,明确盐类水解、电解质电离规律及影响因素是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 一定温度下,15g甲醛和乙酸的混合物中O原子数为0.5NA | |
| B. | pH=1的稀硫酸中含有的H+数为0.1NA | |
| C. | 133g氯化铝分子中含有铝离子的个数为NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
13.下列实验操作中正确的是( )
| A. | 蒸馏时,当烧瓶中液体出现暴沸时,要立即添加碎瓷片 | |
| B. | 蒸发操作时,应使溶液蒸发至干,以保证得到的固体中没有任何水分 | |
| C. | 分液操作时,分液漏斗中下层液体先从下口放出,再让上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
17.化学与生活、生产密切相关.下列食品添加剂中,其使用目的与反应速率有关的是( )
| A. | 调味剂 | B. | 防腐剂 | C. | 增稠剂 | D. | 着色剂 |
6.下列排列顺序正确的是( )
| A. | 热稳定性:HBr<HCl<HF | B. | 原子半径:I<Br<Cl | ||
| C. | 酸性:HClO4<HBrO4<HIO4 | D. | 非金属性:F<Cl<Br |
4.下列关于胶体的叙述正确的是( )
| A. | 胶体区别与其他分散系的本质特征是分散质的粒子直径在1-100nm之间 | |
| B. | 用平行光照射CuSO4溶液和氢氧化铁胶体,不可以加以区分 | |
| C. | 胶体是纯净物 | |
| D. | 树林中的晨曦,该现象与丁达尔效应无关 |
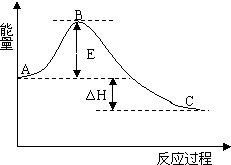 2SO2(g)+O2(g)=2SO3(g) 反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g) 反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: