题目内容
8.短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )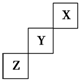
| A. | X、Y、Z三种元素中,与H2化合最容易的是X元素 | |
| B. | 最高价氧化物对应的水化物的酸性:Y>Z | |
| C. | Y的最高正化合价为+7价 | |
| D. | X单质的熔点比Z的低 |
分析 由短周期元素X、Y、Z在元素周期表中的位置可知,X为He,Y为F,Z为S,
A.非金属性越强,与氢气化合越容易;
B.非金属性越强,对应最高价氧化物对应的水化物的酸性越强,但F为正价;
C.Y为F,无正价;
D.常温下S为固体,He为气体.
解答 解:由短周期元素X、Y、Z在元素周期表中的位置可知,X为He,Y为F,Z为S,
A.非金属性最强的为F,则与H2化合最容易的是Y元素,故A错误;
B.非金属性越强,对应最高价氧化物对应的水化物的酸性越强,但F为正价,则Z的最强,故B错误;
C.Y为F,无正价,故C错误;
D.常温下S为固体,He为气体,则X单质的熔点比Z的低,故D正确;
故选D.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
6.已知某溶液中仅含有5种离子(不考虑水的电离和离子的水解),其含量均为1mol,它们可能是K+、Ba2+、Fe2+、Al3+、Fe3+、Mg2+、OH-、HCO3-、CO32-、Cl-、NO3-和SO42-中的5种.为确定该溶液中所含的离子,向该溶液中加入足量稀盐酸,有无色气体产生,且反应前后溶液中的阴离子种类没有变化.则下列说法正确的是( )
| A. | 原溶液中可能含有K+,一定没有HCO3-和OH-,将产生的无色气体通入澄清石灰水中,澄清石灰水变浑浊 | |
| B. | 原溶液中一定含有Cl-和NO3-,可能含有SO42-,反应生成的无色气体遇空气变红棕色 | |
| C. | 原溶液中所含的阳离子为Mg2+、Fe2+,加入稀盐酸所发生的反应为3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 若向原溶液中加入过量NaOH溶液,将所得沉淀过滤、洗涤、灼烧到恒重,得到的固体质量为107 g |
13.下列实验目的无法实现的是( )
| A. | 用激光笔光束鉴别氯化铁溶液和氢氧化铁胶体 | |
| B. | 用KSCN溶液鉴别Fe3+和Fe2+ | |
| C. | 用NaOH溶液和红色石蕊试纸鉴别溶液是否含NH4+ | |
| D. | 在氢氧化钠溶液中滴入氯化铁饱和溶液可以制得氢氧化铁胶体 |
17.常温下,有体积均为10mL、pH均等于1的盐酸和醋酸溶液,下列说法正确的是( )
| A. | 上述两种溶液分别用水稀释m、n倍,溶液的pH都变成3,则m>n | |
| B. | 上述两种溶液分别与足量的Zn完全反应,产生的H2一样多 | |
| C. | 上述两种溶液分别与等浓度的氢氧化钠溶液恰好反应,消耗氢氧化钠溶液的体积相同 | |
| D. | 1mol/L的盐酸和1mol/L的醋酸的混合溶液与氢氧化钠溶液恰好完全反应时,反应后溶液中c(CH3COO-)+C(Cl-)<c(Na+) |
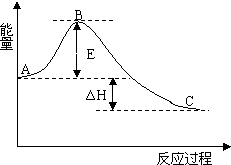 2SO2(g)+O2(g)=2SO3(g) 反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g) 反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: